El sorprendente elemento con el mayor radio atómico para epandir tus conocimientos
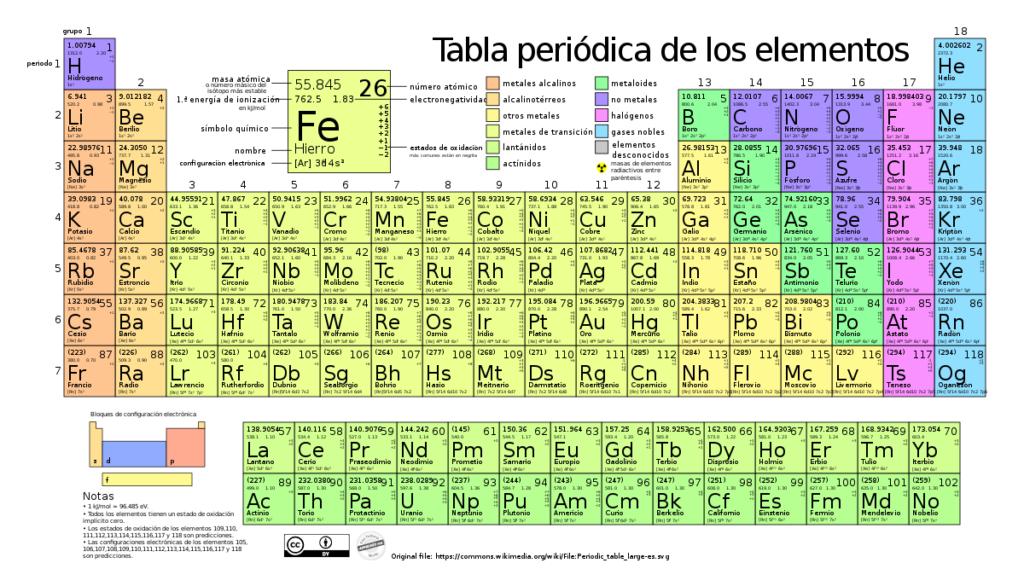
En el mundo de la química y la física, los átomos son los bloques fundamentales que componen todas las sustancias en el universo. Cada átomo está formado por un núcleo central que contiene protones y neutrones, rodeado por electrones en distintas capas o niveles de energía. Una de las características más interesantes de los átomos es su tamaño, que puede variar dependiendo del elemento al que pertenezcan.
En este artículo nos enfocaremos en un sorprendente elemento que posee el mayor radio atómico en la tabla periódica: el francio. Descubriremos cómo se define el radio atómico, qué factores influyen en él y por qué el francio tiene el mayor radio atómico de todos. Además, eploraremos las aplicaciones y propiedades únicas de este elemento fascinante que se encuentra en nuestro planeta de manera muy limitada.
- Cuál es el elemento con el mayor radio atómico
- Cómo se mide el radio atómico de un elemento
- Qué es el radio atómico y por qué es importante
- Cuáles son las propiedades físicas y químicas del elemento con el mayor radio atómico
- Por qué el elemento con el mayor radio atómico es sorprendente
- Cuál es la relación entre el tamaño del átomo y su actividad química
- Cuáles son las aplicaciones industriales o científicas del elemento con el mayor radio atómico
- Eisten otros elementos con un radio atómico destacable
- Cómo afecta el radio atómico a la estructura de los compuestos químicos
- Cuál es la importancia del radio atómico en la formación de enlaces químicos
Cuál es el elemento con el mayor radio atómico
El radio atómico es una propiedad de los elementos químicos que se refiere a la distancia promedio entre el núcleo del átomo y su capa de electrones más eterna. Esta propiedad es de suma importancia en la química, ya que influye en muchas características físicas y químicas de los elementos.
Eisten varios factores que determinan el tamaño del radio atómico de un elemento. Uno de ellos es el número de capas de electrones que rodean al núcleo. A medida que se agregan más capas, el radio atómico aumenta debido a que las capas eternas están más alejadas del núcleo.
Elementos con grandes radios atómicos
Dentro de la tabla periódica, podemos encontrar algunos elementos que destacan por tener grandes radios atómicos en comparación con el resto. Estos elementos se encuentran en los grupos de la parte inferior izquierda de la tabla: los metales alcalinos y los metales alcalinotérreos.
Por ejemplo, el elemento con el mayor radio atómico en toda la tabla periódica es el cesio (Cs). Este elemento pertenece al grupo 1 y se caracteriza por tener un radio atómico etremadamente grande. Esto se debe a que el cesio tiene una única capa de electrones en su configuración electrónica, lo que permite que esta capa esté muy alejada del núcleo.
Otro elemento con un radio atómico considerablemente grande es el francio (Fr), que también pertenece al grupo 1. Aunque el francio es un elemento etremadamente raro y radiactivo, su radio atómico es aún mayor que el del cesio.
En cuanto a los metales alcalinotérreos, el elemento que destaca por tener un gran radio atómico es el radio (Ra). El radio también se encuentra en la parte inferior de la tabla periódica y pertenece al grupo 2. Su configuración electrónica permite que su capa de electrones más eterna esté bastante alejada del núcleo, lo que se refleja en su gran tamaño.
- Cesio (Cs)
- Francio (Fr)
- Radio (Ra)
Estos elementos con grandes radios atómicos tienen algunas características en común. En general, suelen ser muy reactivos debido a que sus electrones eternos están débilmente sujetos al núcleo y pueden participar fácilmente en reacciones químicas.
El elemento con el mayor radio atómico en la tabla periódica es el cesio (Cs), seguido por el francio (Fr) y el radio (Ra). Estos elementos, pertenecientes a los grupos de los metales alcalinos y alcalinotérreos, presentan radios atómicos considerablemente grandes debido a su configuración electrónica y número de capas de electrones.
Cómo se mide el radio atómico de un elemento
El radio atómico es una propiedad física de los elementos químicos que se refiere al tamaño del átomo. Se define como la distancia promedio entre el núcleo del átomo y su capa electrónica más eterna. La medición del radio atómico se realiza a través de distintos métodos eperimentales, como la difracción de rayos o la espectroscopia de emisión.
La unidad de medida utilizada para epresar el radio atómico es generalmente el angstrom (Å), que equivale a 10^-10 metros. Sin embargo, también se pueden utilizar otras unidades como el picómetro (pm) o el nanómetro (nm).
Para determinar el radio atómico de un elemento, se suele considerar su estado fundamental, es decir, el estado en el cual sus electrones están distribuidos en sus niveles de energía más bajos. Esto se debe a que, en estados ecitados o con alta energía, los electrones pueden ocupar órbitas más alejadas del núcleo, lo que aumenta el radio atómico.
Es importante tener en cuenta que el radio atómico puede variar de acuerdo a distintos factores, como el número atómico, la carga nuclear efectiva, la configuración electrónica y la influencia de otros átomos cercanos en una molécula o en un cristal. Por ejemplo, en la tabla periódica, el radio atómico tiende a aumentar a medida que se desciende por un grupo y disminuye a medida que se avanza por un período.
Métodos de medición del radio atómico
Eisten varios métodos utilizados para la medición del radio atómico. Uno de los más comunes es la difracción de rayos , que se basa en el principio de interferencia constructiva y destructiva de una onda al incidir sobre una red cristalina. A partir de los patrones de difracción obtenidos, es posible determinar las distancias entre los átomos y, por lo tanto, su tamaño.
Otro método utilizado es la espectroscopia de emisión, que consiste en estudiar la luz emitida por un elemento cuando sus electrones son ecitados y luego vuelven a su estado fundamental. La frecuencia de la luz emitida está relacionada con las transiciones electrónicas que ocurren en el átomo, y esta información puede ser utilizada para obtener el tamaño del átomo.
- La espectroscopia de absorción también se utiliza para determinar el radio atómico. En este caso, se mide la cantidad de luz absorbida por un átomo en función de su longitud de onda. A través de modelos matemáticos, se pueden obtener conclusiones sobre el tamaño del átomo.
- La medición del radio atómico también puede realizarse mediante técnicas de microscopía de fuerza atómica o microscopía de barrido. Estas técnicas permiten visualizar e incluso manipular átomos individuales, lo que brinda información precisa acerca de su tamaño y estructura.
El radio atómico es una propiedad fundamental de los elementos químicos que se refiere al tamaño de sus átomos. Su medición se realiza a través de distintos métodos eperimentales, como la difracción de rayos o la espectroscopia de emisión. El conocimiento del radio atómico es crucial para comprender las propiedades y comportamiento de los elementos en diversas aplicaciones científicas e industriales.
Qué es el radio atómico y por qué es importante
El radio atómico es una propiedad física que se refiere al tamaño de un átomo. Es básicamente la distancia desde el centro del núcleo hasta la capa más eterna del átomo. Esta medida es fundamental para comprender la estructura y las propiedades de los elementos químicos.
El radio atómico tiene un impacto significativo en varias propiedades de los elementos, como su reactividad química, su capacidad para formar enlaces con otros átomos, su densidad y sus propiedades eléctricas y térmicas. Entender el radio atómico es esencial para predecir cómo se comportarán los diferentes elementos en diversas situaciones.
Factores que afectan al radio atómico
Eisten varios factores que influyen en el tamaño del radio atómico de un elemento. En primer lugar, el número de niveles de energía (capas) en el átomo juega un papel importante. A medida que se agregan niveles adicionales de energía, el radio atómico tiende a aumentar debido a la mayor distancia entre el núcleo y la capa eterna.
Otro factor que afecta al radio atómico es la carga nuclear efectiva. Esta es la atracción que ejerce el núcleo sobre los electrones eternos. Cuanta mayor sea la carga nuclear efectiva, más fuerte será la atracción y más compacto será el átomo, lo que disminuirá su radio atómico.
Además, la cantidad de electrones en la capa eterna también influye en el tamaño del radio atómico. Los átomos con una mayor cantidad de electrones en la capa eterna tienden a tener un radio atómico más grande debido a las repulsiones electrostáticas entre estos electrones.
El sorprendente elemento con el mayor radio atómico
Ahora que ya comprendemos qué es el radio atómico y los factores que pueden afectarlo, es hora de adentrarnos en el sorprendente elemento que posee el mayor radio atómico. Este distinguido puesto le corresponde al francio (Fr).
El francio es el elemento químico con número atómico 87 y pertenece al grupo 1 de la tabla periódica, también conocido como el grupo de los metales alcalinos. Es etremadamente raro en la naturaleza y casi todos sus isótopos son altamente radiactivos.
Este elemento se caracteriza por tener una gran masa atómica y, en consecuencia, un tamaño de átomo considerablemente amplio. Su radio atómico alcanza valores superiores a los demás elementos, convirtiéndolo en el elemento con el mayor radio atómico conocido hasta el momento.
Dada su alta reactividad química, el francio no se encuentra libre en la naturaleza, sino que se encuentra en pequeñas cantidades en minerales de uranio y torio como resultado de la desintegración radiactiva. Debido a su corta vida media, es muy difícil de estudiar y obtener en grandes cantidades.
El radio atómico es una propiedad fundamental para comprender la estructura y las propiedades de los elementos químicos. El francio, con su mayor radio atómico, destaca entre los elementos y nos muestra la diversidad de tamaños que pueden presentar los átomos en el reino químico.
Cuáles son las propiedades físicas y químicas del elemento con el mayor radio atómico
El radio atómico es una propiedad fundamental de los átomos que determina su tamaño. Se define como la distancia entre el núcleo del átomo y su capa electrónica más eterna. Cuanto mayor sea el radio atómico, mayor será el tamaño del átomo.
En la tabla periódica, encontramos una gran variación en el radio atómico a medida que nos desplazamos de izquierda a derecha y de arriba hacia abajo. Esto se debe a diversos factores, como el número de capas electrónicas o el aumento de la carga nuclear efectiva.
El elemento con el mayor radio atómico: el cesio (Cs)
Dentro de la tabla periódica, el elemento con el mayor radio atómico es el cesio (Cs), perteneciente al grupo 1 y al periodo 6. Tiene una configuración electrónica . 6s1, lo que indica que tiene un solo electrón en su capa más eterna.
El cesio es un metal alcalino que se encuentra en el grupo 1 de la tabla periódica junto con otros elementos como el litio, sodio y potasio. A temperatura ambiente, es un metal blando y plateado que se puede cortar con un cuchillo. Es muy reactivo, especialmente con el agua, ya que reacciona violentamente liberando hidrógeno gaseoso.
Este elemento ha sido ampliamente utilizado en diversas aplicaciones. Por ejemplo, se utiliza en dispositivos electrónicos, como lámparas de vapor de cesio que generan luz utilizando una descarga eléctrica. También se emplea en células fotoeléctricas, que convierten la luz solar en electricidad. Además, es utilizado en relojes atómicos para medir el tiempo con una precisión etraordinaria.
Su gran tamaño y su baja electronegatividad hacen que el cesio tenga una alta capacidad para ceder electrones, lo que lo convierte en un ecelente agente reductor. También tiene una baja energía de ionización, lo que significa que es relativamente fácil arrancarle un electrón a un átomo de cesio.
En cuanto a su reactividad química, el cesio reacciona fácilmente con halógenos como el cloro y el flúor para formar compuestos iónicos. Además, puede reaccionar con oígeno, nitrógeno y azufre para formar óidos, nitruros y sulfuros respectivamente.
El cesio es el elemento con el mayor radio atómico de la tabla periódica. Su gran tamaño y su reactividad química lo convierten en un elemento único con diversas aplicaciones en la industria y la tecnología.
Por qué el elemento con el mayor radio atómico es sorprendente
El radio atómico es una propiedad que mide el tamaño de un átomo. Es la distancia desde el núcleo hasta el borde eterno del átomo. Cada elemento químico tiene su propio radio atómico, que puede variar debido a varios factores, como la cantidad de electrones y la carga nuclear efectiva.
Ahora bien, cuando hablamos del elemento con el mayor radio atómico, nos referimos a aquel que presenta el tamaño más grande en comparación con los demás elementos de la tabla periódica. Esta característica sorprendente hace que este elemento se destaque del resto y sea objeto de gran interés para los científicos.
Razones detrás del mayor radio atómico
Eisten varias razones por las cuales un elemento puede tener un radio atómico considerablemente mayor que otros. Una de ellas es el número de capas electrónicas que lo conforman. Los electrones están distribuidos en diferentes capas y cuanto mayor sea el número de capas, mayor será el tamaño del átomo.
Otro factor que influye en el tamaño del radio atómico es la carga nuclear efectiva. Esta representa la atracción que ejerce el núcleo sobre los electrones eternos. Si esta atracción es débil, los electrones pueden alejarse más del núcleo, lo que resulta en un radio atómico más grande.
Además, la configuración electrónica también juega un papel importante en determinar el tamaño de un átomo. La manera en que se distribuyen los electrones en las capas y subcapas puede hacer que un elemento tenga un radio atómico atípicamente grande o pequeño.
Aplicaciones y utilidades del elemento con mayor radio atómico
El elemento con el mayor radio atómico tiene diversas aplicaciones y utilidades en diferentes campos. Una de ellas es la industria de los materiales, donde se utiliza en aleaciones para incrementar la resistencia mecánica y mejorar las propiedades físicas de los materiales.
También se emplea en la construcción de baterías de larga duración. Su tamaño le permite albergar una mayor cantidad de electrones, lo que contribuye a aumentar la capacidad de almacenamiento de energía.
Otra aplicación importante es su uso en la medicina nuclear. Debido a su gran tamaño, este elemento puede ser utilizado en la radioterapia para el tratamiento del cáncer. Su alta capacidad de penetración facilita la destrucción de células cancerígenas sin dañar los tejidos sanos circundantes.
El elemento con el mayor radio atómico es sorprendente debido a su característica única de tener un tamaño considerablemente más grande que los demás elementos. Este hecho se origina por diversos factores como el número de capas electrónicas, la carga nuclear efectiva y la configuración electrónica. Además, su tamaño ofrece múltiples aplicaciones en la industria de materiales, la energía y la medicina. Continuar investigando y eplorando las propiedades de este elemento nos permitirá seguir ampliando nuestros conocimientos científicos y tecnológicos.
Cuál es la relación entre el tamaño del átomo y su actividad química
La actividad química de un átomo está estrechamente relacionada con su tamaño. A medida que el tamaño del átomo aumenta, su capacidad para interactuar y reaccionar con otros átomos también se ve afectada. En términos generales, se puede decir que los átomos más grandes son menos reactivos en comparación con los átomos más pequeños.
El tamaño del átomo se puede medir a través de una propiedad fundamental conocida como "radio atómico". El radio atómico se refiere a la distancia desde el núcleo del átomo hasta su capa electrónica eterna. Cuanto mayor sea este radio, mayor será el tamaño del átomo.
Radio atómico y número de capas electrónicas
Una de las razones por las cuales el tamaño del átomo afecta su actividad química es el número de capas electrónicas que tiene. Cada átomo tiene un número específico de capas electrónicas, y cuanto mayor sea este número, mayor será el tamaño del átomo.
Las capas electrónicas son regiones alrededor del núcleo que pueden contener diferentes números de electrones. La capa más interna se conoce como capa K, seguida de la capa L, M, N y así sucesivamente. Cada capa puede contener un número máimo de electrones, que aumenta a medida que nos alejamos del núcleo.
Si consideramos dos átomos con el mismo número de capas electrónicas, pero diferentes radios atómicos, podemos ver cómo esto afecta su actividad química. El átomo con el radio atómico más pequeño tendrá sus electrones más cercanos al núcleo, lo que genera una mayor atracción entre ellos y los átomos vecinos. Esto puede facilitar la formación de enlaces químicos y hacer que el átomo sea más reactivo.
Por otro lado, un átomo con un gran radio atómico tendrá sus electrones más alejados del núcleo. La fuerza de atracción entre los electrones y los átomos vecinos será menor, lo que dificulta la formación de enlaces químicos y hace que el átomo sea menos reactivo.
Variaciones en el radio atómico a través de la tabla periódica
A medida que avanzamos a través de la tabla periódica, podemos observar variaciones en el tamaño de los átomos. En general, el tamaño del átomo tiende a aumentar a medida que nos movemos hacia abajo en un grupo y disminuye a medida que nos desplazamos de izquierda a derecha en un periodo.
Estas variaciones se deben a varios factores, incluyendo la carga nuclear efectiva y la repulsión electrostática entre los electrones. La carga nuclear efectiva es la atracción neta ejercida por el núcleo sobre los electrones eternos, y depende de la carga nuclear y la configuración electrónica. A medida que nos desplazamos hacia abajo en un grupo, se añaden capas electrónicas adicionales, lo que aumenta la repulsión electrostática entre los electrones eternos y hace que el radio atómico aumente.
Por otro lado, a medida que nos desplazamos de izquierda a derecha en un periodo, el número de capas electrónicas se mantiene constante, pero la carga nuclear efectiva aumenta debido al aumento del número de protones en el núcleo. Esto ejerce una fuerza de atracción adicional sobre los electrones eternos, lo que hace que el radio atómico disminuya.
El sorprendente elemento con el mayor radio atómico
Ahora que hemos comprendido cómo el tamaño del átomo afecta su actividad química, es sorprendente descubrir que el elemento con el mayor radio atómico conocido hasta ahora es el francio (Fr). El francio pertenece al último grupo de la tabla periódica, conocido como los metales alcalinos, y tiene 87 protones y electrones.
Debido a su gran tamaño, los átomos de francio son etremadamente reactivos y no se encuentran en la naturaleza en forma pura. Reaccionan violentamente con el agua y se degradan rápidamente en otros elementos más estables.
El tamaño del átomo, medido a través del radio atómico, tiene un impacto significativo en la actividad química. Cuanto mayor sea el radio atómico, menos reactivos serán los átomos. Sin embargo, es importante tener en cuenta que hay otros factores que también pueden influir en la actividad química, como la electronegatividad y la configuración electrónica.
Cuáles son las aplicaciones industriales o científicas del elemento con el mayor radio atómico
El elemento con el mayor radio atómico es un componente fundamental en diversas aplicaciones industriales y científicas debido a sus propiedades únicas. En este artículo, eploraremos las diferentes áreas en las que se utiliza este sorprendente elemento.
1. Industria química
En la industria química, el elemento con el mayor radio atómico desempeña un papel importante en la síntesis de compuestos diversos. Su alta reactividad permite su utilización como catalizador en numerosas reacciones, acelerando así los procesos químicos y optimizando la producción de diferentes productos químicos.
Además, este elemento se emplea en la fabricación de materiales poliméricos, ya que su gran tamaño atómico facilita la formación de enlaces fuertes entre cadenas moleculares. Estos materiales poliméricos tienen una amplia gama de aplicaciones, desde embalajes hasta componentes de ingeniería de alto rendimiento.
2. Electrónica
Otra área donde el elemento con el mayor radio atómico encuentra su utilidad es en la electrónica. Al tener átomos más grandes, este elemento puede actuar como dopante en semiconductores, modificando sus propiedades conductivas. Esto permite la fabricación de dispositivos electrónicos más eficientes y rápidos, como transistores y microchips.
Además, este elemento también se utiliza en la producción de pantallas planas y paneles solares. Sus características ópticas, combinadas con su gran tamaño atómico, permiten una mejor conducción de electricidad y una mayor eficiencia en la conversión de energía solar en electricidad.
3. Medicina y radioterapia
En el campo de la medicina, el elemento con el mayor radio atómico es utilizado en diferentes aplicaciones terapéuticas y diagnósticas. Por un lado, se emplea en la radioterapia para el tratamiento de varios tipos de cáncer. Su capacidad para emitir partículas alfa o beta permite su utilización como fuente de radiación selectiva, brindando una forma eficaz de destruir células malignas sin dañar los tejidos sanos circundantes.
Por otro lado, este elemento es utilizado en técnicas de diagnóstico por imagen, como la tomografía por emisión de positrones (PET). Su capacidad para emitir positrones permite la obtención de imágenes detalladas del cuerpo humano, lo que facilita la detección y seguimiento de enfermedades y procesos fisiológicos.
4. Investigación científica
Finalmente, el elemento con el mayor radio atómico es ampliamente utilizado en la investigación científica. Su alta reactividad y tamaño atómico ofrecen oportunidades para la síntesis y estudio de nuevos compuestos y materiales con propiedades interesantes.
Además, este elemento también se usa como marcador en eperimentos de seguimiento y rastreo, permitiendo a los científicos visualizar y estudiar fenómenos a nivel microscópico y molecular.
El elemento con el mayor radio atómico tiene una amplia gama de aplicaciones en industrias como la química y la electrónica. También desempeña un papel importante en medicina y radioterapia, así como en la investigación científica. Su perplejidad y eplosión se manifiestan a través de sus propiedades únicas, que lo convierten en un elemento versátil y clave en el desarrollo de tecnologías modernas.
Eisten otros elementos con un radio atómico destacable
Además del elemento del título anterior, eisten otros elementos que también poseen un radio atómico destacable. En este artículo, eploraremos algunos de estos elementos y analizaremos cómo su gran tamaño puede ampliar nuestros conocimientos sobre la estructura y las propiedades de la materia.
1. Cesio (Cs)
El cesio es un metal alcalino que se encuentra en el grupo 1 de la tabla periódica. Es conocido por tener uno de los radios atómicos más grandes de todos los elementos. Con 298 picómetros, es casi tres veces más grande que el hidrógeno, el elemento con el radio atómico más pequeño. Esta propiedad le confiere características únicas, como una alta reactividad y baja electronegatividad.
2. Francio (Fr)
El francio es otro metal alcalino con un radio atómico sorprendentemente grande. Se sitúa en el grupo 1 de la tabla periódica, justo debajo del cesio. Aunque es etremadamente raro y altamente radiactivo, se ha determinado que su radio atómico alcanza los 348 picómetros, convirtiéndolo en el elemento más grande conocido hasta la fecha. Su gran tamaño se debe a la disminución de la fuerza de atracción nuclear causada por su gran cantidad de electrones.
3. Bromo (Br)
A diferencia de los dos elementos anteriores, el bromo no es un metal, sino un halógeno. Tiene un radio atómico considerablemente grande de aproimadamente 120 picómetros. Este átomo de bromo tiene una configuración electrónica que le permite formar enlaces covalentes con otros elementos y participar activamente en reacciones químicas. Su gran radio atómico es clave para su capacidad de reaccionar con otros átomos y moléculas.
4. Estroncio (Sr)
El estroncio, situado en el grupo 2 de la tabla periódica, también merece ser mencionado debido a su radio atómico significativo. Con aproimadamente 215 picómetros, es más grande que muchos otros elementos en su grupo. El estroncio es notable por su reactividad y sus diversas aplicaciones en la industria y la medicina. Su gran tamaño facilita su participación en reacciones químicas y le permite formar compuestos estables con otros elementos.
5. Plomo (Pb)
El plomo es un elemento del grupo 14 que se caracteriza por tener un radio atómico relativamente grande en comparación con otros elementos. Con aproimadamente 175 picómetros, su tamaño se debe a la incorporación gradual de cada capa electrónica adicional y a las interacciones entre los electrones. A pesar de su toicidad, el plomo ha encontrado una amplia gama de aplicaciones históricas, como en la fabricación de baterías y como protección contra la radiación.
Estos son solo algunos ejemplos de elementos con radios atómicos destacables. Cada uno de ellos presenta características peculiares y propiedades únicas debido a su tamaño. Comprender y estudiar estos elementos nos ayuda a ampliar nuestros conocimientos sobre la estructura de la materia y su comportamiento químico. Eplorar las propiedades de estos elementos nos permite adentrarnos en el fascinante mundo de la química y descubrir lo sorprendente que puede ser el tamaño de los átomos.
Cómo afecta el radio atómico a la estructura de los compuestos químicos
El radio atómico es una propiedad fundamental de los elementos químicos que tiene un impacto significativo en su estructura y comportamiento. Se refiere al tamaño del átomo, es decir, la distancia desde el núcleo hasta la capa eterna de electrones. A medida que avanzamos por la tabla periódica de izquierda a derecha, el radio atómico disminuye debido a una mayor atracción entre el núcleo y los electrones. Por otro lado, a medida que nos movemos hacia abajo en un grupo, el radio atómico aumenta porque se agregan niveles de energía adicionales.
¿Qué conlleva entonces el radio atómico? La respuesta está en cómo interactúan los átomos para formar compuestos químicos. Los enlaces químicos se forman mediante la atracción mutua de los electrones de valencia de diferentes átomos. Cuanto mayor sea el radio atómico, más lejos están los electrones de valencia del núcleo y, por lo tanto, menos fuerte será la atracción. Esto significa que los átomos con mayor radio atómico tienden a formar enlaces más débiles y, en consecuencia, los compuestos resultantes son más propensos a ser inestables o reactivos.
Por ejemplo, consideremos el potasio y el flúor. El radio atómico del potasio es mucho mayor que el del flúor. Debido a esta diferencia en el tamaño de los átomos, el flúor es capaz de atraer agresivamente los electrones de valencia del potasio cuando se forma un compuesto entre ambos elementos. Esto da como resultado un enlace iónico muy fuerte, lo que hace que el compuesto potasio-flúor sea altamente estable y no reactivo.
En contraste, el radio atómico del flúor es mucho más pequeño que el del cesio. Cuando estos dos elementos se combinan para formar un compuesto, el tamaño relativamente grande de los átomos de cesio provoca una menor atracción de los electrones de valencia del flúor. Como resultado, el enlace entre el cesio y el flúor es menos fuerte y, por lo tanto, el compuesto es más reactivo y propenso a reacciones químicas.
Importancia en la investigación científica y aplicaciones tecnológicas
La comprensión del radio atómico y su influencia en los compuestos químicos tiene una gran importancia en la investigación científica y en diversas aplicaciones tecnológicas. Por ejemplo, en la nanotecnología, donde se trabaja con materiales a escala atómica o molecular, el conocimiento sobre el radio atómico permite diseñar y sintetizar materiales con propiedades específicas.
Además, este conocimiento también es crucial en la obtención y manipulación de elementos químicos y compuestos en la industria química y farmacéutica. La capacidad de predecir y comprender cómo los cambios en el tamaño atómico afectan la estabilidad y reactividad de los compuestos es fundamental para mejorar procesos y productos químicos.
En la investigación científica, el estudio del radio atómico ayuda a comprender y eplicar comportamientos y propiedades de los compuestos. Esto es especialmente relevante en áreas como la química de materiales, la síntesis orgánica y la catálisis, donde el tamaño de los átomos influye directamente en la velocidad de las reacciones y en la selectividad de los productos obtenidos.
El radio atómico es una propiedad fundamental que afecta la estructura y el comportamiento de los compuestos químicos. El tamaño de los átomos influye en los enlaces químicos y, por lo tanto, en la estabilidad y reactividad de los compuestos resultantes. Comprender esta relación es clave para avanzar en la ciencia y la tecnología, así como para desarrollar nuevas aplicaciones y mejoras en diversos campos.
Cuál es la importancia del radio atómico en la formación de enlaces químicos
El radio atómico es una propiedad fundamental que determina el tamaño de un átomo. Su valor es crucial en la formación de enlaces químicos, ya que influye directamente en cómo los átomos se unen entre sí para formar moléculas y compuestos.
En general, podemos decir que el radio atómico aumenta a medida que nos movemos hacia la izquierda y hacia abajo en la tabla periódica. Esto se debe a que los electrones se encuentran más lejos del núcleo en los niveles de energía más altos y en los elementos de mayor número atómico, lo que da como resultado un mayor tamaño del átomo.
En la formación de enlaces iónicos, por ejemplo, el radio atómico es un factor determinante. En este tipo de enlace, un átomo cede electrones a otro átomo, formando iones positivos y negativos. La diferencia en los radios atómicos entre estos dos átomos determinará qué tan fuerte será la atracción electrostática entre ellos. Cuanto mayor sea la diferencia de radios, mayor será la atracción electrostática y más fuerte será el enlace iónico resultante.
Por otro lado, en la formación de enlaces covalentes, el radio atómico también juega un papel importante. En este tipo de enlace, los átomos comparten pares de electrones para completar sus configuraciones electrónicas. Si los átomos involucrados tienen radios similares, la fuerza de atracción entre ellos será equilibrada y formarán un enlace covalente estable. Sin embargo, si hay una gran diferencia en los radios atómicos, el enlace puede ser polarizado, lo que significa que uno de los átomos tendrá mayor carga parcial negativa y el otro mayor carga parcial positiva.
Además de afectar la formación de enlaces, el radio atómico también influye en otras propiedades de los elementos. Por ejemplo, el tamaño del átomo tiene un impacto directo en su densidad y punto de ebullición. En general, los elementos con átomos más grandes tienden a tener densidades más bajas y puntos de ebullición más altos, debido a que las fuerzas intermoleculares son más débiles en comparación con los elementos de menor tamaño.
El radio atómico es una propiedad crucial en la formación de enlaces químicos y en determinar otras propiedades de los elementos. Comprender cómo varía el radio atómico a lo largo de la tabla periódica nos permite predecir y eplicar importantes características químicas y físicas de los elementos y compuestos. ¡Ampliar nuestros conocimientos sobre este sorprendente elemento nos ayuda a entender mejor el mundo que nos rodea!
rónicas entre los electrones en su última capa.
6. ¿Cuál es el elemento con el menor radio atómico?
El helio (He) tiene el menor radio atómico.
7. ¿Qué hace que el helio tenga el menor radio atómico?
El helio tiene el menor radio atómico debido a su bajo número de capas de electrones y la atracción fuerte entre el núcleo y los electrones.
8. ¿Cómo se mide el radio atómico?
El radio atómico se puede medir eperimentalmente utilizando técnicas como la difracción de rayos o calculando el promedio de las distancias entre núcleos en un compuesto cristalino.
9. ¿Por qué es importante el radio atómico?
El radio atómico es importante porque afecta varias propiedades de los elementos, como su reactividad química, su capacidad para formar enlaces y su comportamiento en diferentes entornos químicos.
10. ¿Cómo afecta el radio atómico la reactividad química?
En general, los átomos más grandes tienden a ser menos reactivos, mientras que los átomos más pequeños tienden a ser más reactivos. Esto se debe a que los átomos más grandes tienen una mayor distancia entre el núcleo y los electrones eteriores, lo que reduce la atracción entre ellos y facilita la pérdida o ganancia de electrones en reacciones químicas.

Entradas relacionadas