Configuración electrónica: Descubre paso a paso cómo se hace y mejora tus habilidades
La configuración electrónica es un concepto fundamental en la química y física, ya que nos permite comprender cómo se organizan los electrones alrededor del núcleo de un átomo. Esta organización determina las propiedades químicas y físicas de los elementos, así como su capacidad para formar enlaces y reaccionar con otras sustancias.
Por lo tanto, entender la configuración electrónica es crucial para comprender el comportamiento de los átomos y las moléculas.
Te guiaré paso a paso en el proceso de configuración electrónica, desde la identificación del elemento hasta la determinación del número de electrones en cada nivel y subnivel. Además, aprenderás los principios y reglas que rigen la distribución de los electrones en los orbitales y cómo utilizar la tabla periódica para facilitar este proceso.
No importa si eres estudiante o simplemente buscas mejorar tus habilidades en química, este artículo te proporcionará los conocimientos necesarios para dominar la configuración electrónica y establecer una base sólida en ciencias naturales.
- Qué es la configuración electrónica y por qué es importante en química
- Cuál es el principio clave detrás de la configuración electrónica
- Cómo se representan los electrones en un átomo
- Cuál es la regla del Aufbau y cómo se utiliza para determinar la configuración electrónica
- Cuáles son las ecepciones a la regla del Aufbau
- Cómo se lee la tabla periódica para determinar la configuración electrónica de un elemento
- Por qué algunos elementos tienen configuraciones electrónicas inusuales
- Qué es la notación abreviada de la configuración electrónica y cómo se usa
- Cómo se calcula el número de electrones no emparejados en un átomo utilizando la configuración electrónica
- Cómo influye la configuración electrónica en las propiedades químicas de los elementos
- Cuál es la importancia de comprender y dominar la configuración electrónica para mejorar tus habilidades en química
- Cuáles son algunos consejos y trucos útiles para recordar la configuración electrónica de los elementos
- Preguntas frecuentes (FAQ)
Qué es la configuración electrónica y por qué es importante en química
La configuración electrónica es una representación de cómo están distribuidos los electrones en un átomo. Es fundamental para comprender el comportamiento químico de los elementos y su capacidad para formar enlaces. El estudio de la configuración electrónica nos permite entender las propiedades y el comportamiento de los átomos y cómo interactúan entre sí.
En química, los electrones juegan un papel crucial en la determinación de las propiedades de los elementos. La configuración electrónica proporciona información valiosa sobre cómo se distribuyen los electrones en las diferentes capas de energía alrededor del núcleo atómico. Esta disposición determina tanto las propiedades físicas como las propiedades químicas de los elementos.
Importancia de la configuración electrónica en química
La configuración electrónica influye en varios aspectos químicos clave:
- Propiedades periódicas: La configuración electrónica de un elemento se correlaciona directamente con su posición en la tabla periódica. A medida que avanzamos a lo largo de un período, los electrones se agregan a capas de energía más eternas, lo que resulta en un aumento en el tamaño del átomo. Además, la configuración electrónica influye en la carga nuclear efectiva, que afecta la atracción de los electrones hacia el núcleo y, por lo tanto, las propiedades ionización y afinidad electrónica.
- Propiedades de enlace: La configuración electrónica determina la capacidad de un átomo para formar enlaces químicos con otros átomos. Los electrones de valencia, aquellos ubicados en la capa más eterna, son los principales responsables de las interacciones químicas y determinan tanto la capacidad del átomo para perder o ganar electrones como su tendencia a compartirlos con otros átomos.
- Reactividad química: La configuración electrónica también influye en la reactividad química de un elemento. Los elementos con configuraciones electrónicas similares tienden a ehibir propiedades y comportamientos químicos similares. Por ejemplo, los elementos del grupo de los halógenos comparten una configuración electrónica similar, lo que les confiere características reactivas igualmente similares.
La configuración electrónica es una herramienta fundamental en química que nos permite comprender las propiedades y el comportamiento de los elementos. Su conocimiento mejora nuestra comprensión de los procesos químicos y nos ayuda a predecir y eplicar fenómenos químicos con mayor precisión.
Cuál es el principio clave detrás de la configuración electrónica
La configuración electrónica es el proceso mediante el cual se organizan los electrones en un átomo. Es un principio clave en la química y la física, ya que determina las propiedades y el comportamiento de los elementos.
Para entender cómo se realiza la configuración electrónica, primero debemos recordar algunas nociones básicas sobre la estructura del átomo. Un átomo consta de un núcleo central compuesto por protones y neutrones, alrededor del cual orbitan los electrones. Cada electrón tiene una carga negativa y está asociado a un nivel energético determinado.
Los niveles energéticos del átomo se dividen en subniveles, que a su vez se subdividen en orbitales. Cada orbital puede contener hasta dos electrones con espines opuestos, siguiendo el principio de eclusión de Pauli.
Pasos para realizar la configuración electrónica
A continuación, describiremos paso a paso cómo se realiza la configuración electrónica:
1.Identificar el número atómico del elemento: El número atómico representa la cantidad de protones en el núcleo del átomo. Este número define el elemento químico y permite determinar su posición en la tabla periódica.2.Determinar la distribución de electrones: Para ello, se utilizan los diagramas de niveles de energía y las reglas de llenado de orbitales. Estas reglas están basadas en los principios de Aufbau, Hund y Mitad Llena.3.Llenar los orbitales teniendo en cuenta las reglas y principios mencionados anteriormente. Se debe seguir un orden ascendente de niveles de energía y llenar los orbitales de menor a mayor energía.4.Indicar la distribución electrónica final: Una vez completada la distribución de electrones, se escribe la configuración electrónica del átomo utilizando el símbolo del elemento y los subíndices correspondientes al número de electrones en cada nivel y orbital. Por ejemplo, la configuración electrónica del oígeno es 1s² 2s² 2p⁴.
Es importante destacar que la configuración electrónica influye en las propiedades químicas de los elementos, como su capacidad para formar enlaces y establecer reacciones químicas. Además, permite comprender la estabilidad y la estructura de los compuestos químicos.
Para mejorar las habilidades en la configuración electrónica, es recomendable practicar con ejercicios y problemas que requieran determinar la distribución de electrones en diferentes átomos y iones. También es útil familiarizarse con los diferentes grupos y periodos de la tabla periódica, ya que esto proporciona información sobre la configuración electrónica de los elementos.
La configuración electrónica es el proceso clave que define cómo se organizan los electrones en un átomo. Comprender este principio es fundamental para entender las propiedades y el comportamiento de los elementos químicos.
Cómo se representan los electrones en un átomo
En química, la configuración electrónica es la distribución estructurada de los electrones en los diferentes niveles y subniveles de energía en un átomo. Esta distribución es crucial, ya que determina las propiedades químicas del elemento y su capacidad para formar enlaces con otros átomos.
Para representar los electrones en un átomo, se utilizan distintos símbolos y notaciones. La más comúnmente empleada es la notación espectroscópica, también conocida como notación de términos. En esta notación, el nivel de energía (o capa electrónica) se representa mediante una letra mayúscula, mientras que el subnivel (o orbital) se indica con una letra minúscula o un número.
Por ejemplo, si consideramos el átomo de carbono, cuya configuración electrónica es 1s2, 2s2, 2p2, podemos interpretar lo siguiente:
- El primer número, '1', representa el nivel de energía o capa electrónica más cercana al núcleo. En este caso, corresponde a la capa K.
- La letra 's' representa el subnivel s, que tiene una forma esférica y puede albergar un máimo de 2 electrones.
- El eponente '2' indica la cantidad de electrones presentes en el subnivel s. En este caso, hay 2 electrones en el subnivel s de la capa K.
De manera similar, el número '2' indica que la configuración electrónica continúa en la capa L. El subnivel 2s puede albergar también un máimo de 2 electrones, mientras que el subnivel 2p tiene una forma lobular y puede alojar un máimo de 6 electrones.
En este caso específico, hay 2 electrones en el subnivel 2s y 2 electrones en el subnivel 2p del átomo de carbono.
Principio de eclusión de Pauli y regla de Hund
La distribución de los electrones en los diferentes subniveles sigue el principio de eclusión de Pauli y la regla de Hund. El principio de eclusión de Pauli establece que no puede haber más de dos electrones en un orbital, y si hay dos electrones, deben tener espines opuestos.
Por su parte, la regla de Hund establece que al llenar orbitales de igual energía, los electrones se distribuirán de manera tal que haya la mayor cantidad posible de espines paralelos antes de apareamiento.
Estas reglas son fundamentales para determinar la distribución electrónica correcta de un átomo y permiten comprender la estabilidad y reactividad de los elementos químicos en diversas situaciones.
La configuración electrónica representa la forma ordenada y estructurada en la que los electrones se distribuyen en los diferentes niveles y subniveles de energía en un átomo. Esta distribución se representa mediante símbolos y notaciones como la notación espectroscópica. Además, la distribución de los electrones sigue principios como el principio de eclusión de Pauli y la regla de Hund. Entender la configuración electrónica es fundamental para comprender las propiedades químicas de los elementos y su capacidad para formar enlaces.
Cuál es la regla del Aufbau y cómo se utiliza para determinar la configuración electrónica
La configuración electrónica es una representación de cómo se distribuyen los electrones en los distintos niveles y subniveles de un átomo. Esto nos permite comprender mejor las propiedades y comportamientos de los elementos químicos.
Una de las reglas fundamentales que rige la configuración electrónica es la regla del Aufbau, también conocida como principio de construcción progresiva. Esta regla nos indica que los electrones deben llenar los orbitales más cercanos al núcleo antes de pasar a los orbitales más alejados.
Para determinar la configuración electrónica de un átomo, primero debemos conocer el número atómico, que representa la cantidad de protones en el núcleo del átomo. A partir de este número, podemos ir llenando los orbitales siguiendo la regla del Aufbau.
Comenzamos llenando el primer nivel, conocido como capa K, que corresponde al orbital s. Este orbital tiene capacidad para un máimo de 2 electrones. Luego, pasamos al segundo nivel, capa L, donde se encuentran los orbitales s y p. El orbital s de la capa L también puede alojar hasta 2 electrones, mientras que los orbitales p pueden contener un máimo de 6 electrones. Continuamos llenando los sucesivos niveles, capas M, N, O, P, etc., respetando siempre la secuencia s, p, d, f.
Es importante tener en cuenta que eisten algunas ecepciones a la regla del Aufbau. Por ejemplo, en algunos casos, para lograr mayor estabilidad, se produce una redistribución de los electrones entre los orbitales. Esta redistribución se debe a la interacción electrostática entre los electrones, que puede llevar a que un orbital de menor energía se complete antes que otro de mayor energía.
Además de la regla del Aufbau, también es necesario tener en cuenta el principio de eclusión de Pauli, que establece que cada orbital puede ocuparse por un máimo de 2 electrones con espines opuestos, y la regla de Hund, que indica que los electrones tienden a ocupar órbitas diferentes dentro de un mismo subnivel hasta que no queden orbitales vacíos.
La regla del Aufbau es fundamental para determinar la configuración electrónica de un átomo. Esta regla nos permite entender cómo se distribuyen los electrones en los distintos niveles y subniveles, siguiendo una secuencia lógica. Sin embargo, también debemos tener en cuenta ecepciones y otros principios para comprender mejor las características de los elementos químicos.
Cuáles son las ecepciones a la regla del Aufbau
Cuando se trata de la configuración electrónica de los átomos, eiste una regla general conocida como la regla del Aufbau. Esta regla establece que los electrones se llenan en los orbitales de menor energía primero antes de pasar a los orbitales de mayor energía. Sin embargo, hay casos en los que se presentan ecepciones a esta regla.
1. Ecepción de medio llenado
Una de las ecepciones más comunes es conocida como la ecepción de medio llenado. Esta ecepción ocurre cuando un átomo tiene la posibilidad de alcanzar una configuración electrónica de medio llenado o un cuarteto de electrones desapareados en la última capa.
Por ejemplo, consideremos el caso del cromo (Cr) que tiene una configuración electrónica esperada de . 4s1 3d5.
2. Ecepción de subnivel semilleno
Otra ecepción importante es la ecepción de subnivel semilleno. Esta ecepción se produce cuando un átomo tiene la posibilidad de alcanzar una configuración de subnivel semilleno o un número par de electrones desapareados en la última capa.
Un ejemplo común de esta ecepción es el caso del cobre (Cu) que tiene una configuración electrónica esperada de . 4s1 3d10.
3. Ecepción de estabilidad nuclear
La ecepción final es conocida como la ecepción de estabilidad nuclear. Esta ecepción se produce cuando un átomo tiene la posibilidad de alcanzar una configuración electrónica que resulta en una mayor estabilidad debido a la repulsión entre los electrones y la atracción del núcleo.
Un ejemplo notable de esta ecepción es el caso del mercurio (Hg) que tiene una configuración electrónica esperada de . 6s2 4f14 5d10 6p0.
Las ecepciones a la regla del Aufbau ocurren cuando los átomos buscan alcanzar configuraciones electrónicas más estables que se desvían de la secuencia habitual de llenado de orbitales de menor a mayor energía. Estas ecepciones son importantes para comprender la estructura electrónica de los átomos y cómo afectan a sus propiedades químicas.
Cómo se lee la tabla periódica para determinar la configuración electrónica de un elemento
La configuración electrónica de un elemento es la distribución de los electrones en los diferentes niveles y subniveles de energía alrededor del núcleo atómico. Entender cómo leer la tabla periódica te permitirá determinar fácilmente la configuración electrónica de cualquier elemento.
Paso 1: Identifica el número atómico
El primer paso para determinar la configuración electrónica de un elemento es identificar su número atómico, que se encuentra en la parte superior de cada casilla de la tabla periódica. El número atómico corresponde al número de protones en el núcleo del átomo y también determina el número de electrones en estado neutro.
Paso 2: Asigna los electrones a los niveles de energía
Una vez que hayas identificado el número atómico del elemento, procede a asignar los electrones a los diferentes niveles de energía. Los niveles de energía están representados por las filas horizontales de la tabla periódica y están numerados del 1 al 7, comenzando desde el nivel más cercano al núcleo (nivel 1) hasta el más alejado (nivel 7). Cada nivel tiene una cantidad máima de electrones que puede alojar:
Nivel 1: 2 electrones
Nivel 2: 8 electrones
Nivel 3: 8 electrones
Nivel 4: 18 electrones
Nivel 5: 18 electrones
Nivel 6: 32 electrones
Nivel 7: 32 electrones
Es importante recordar que los electrones se asignan de manera ordenada, comenzando desde el nivel más cercano al núcleo y siguiendo hasta alcanzar el número atómico del elemento. Por ejemplo, si el número atómico es 10, los primeros 2 electrones se colocarán en el nivel 1, mientras que los 8 restantes irán al nivel 2.
Paso 3: Asigna los electrones a los subniveles de energía
Una vez que hayas asignado los electrones a los niveles de energía, es hora de distribuirlos dentro de los subniveles de cada nivel. Los subniveles de energía están representados por las letras s, p, d y f, y cada uno puede albergar una cantidad máima de electrones:
Subnivel s: 2 electrones
Subnivel p: 6 electrones
Subnivel d: 10 electrones
Subnivel f: 14 electrones
La forma en que se asignan los electrones a los subniveles sigue un patrón específico conocido como "diagrama de orbitales". Este diagrama muestra las diferentes órbitas a las que los electrones pueden pertenecer y cómo se llenan en orden de menor a mayor energía.
Por ejemplo, si tenemos un elemento con número atómico 11 (sodio), los primeros 2 electrones irán al subnivel 1s, mientras que el tercer electrón se colocará en el subnivel 2s. Los 8 electrones restantes se asignarán al subnivel 2p, donde se llenarán los tres orbitales p antes de comenzar a ocupar un segundo electrón en cada uno.
Paso 4: Consulta la distribución electrónica por configuración abreviada
Otro método para determinar la configuración electrónica de un elemento es utilizar la configuración abreviada, que se basa en el gas noble más cercano (el cual se encuentra a la izquierda del elemento en la tabla periódica) y luego añade los electrones restantes.
Por ejemplo, si queremos determinar la configuración electrónica del níquel (Ni), podemos observar que el argón (Ar) es el gas noble más cercano con una configuración electrónica completa (1s2 2s2 2p6 3s2 3p6). A partir de ahí, agregamos los electrones restantes del níquel: 4s2 3d8.
Recuerda que la configuración electrónica puede variar dependiendo del estado de oidación y otros factores, por lo que siempre es importante consultar datos actualizados y fuentes confiables para obtener la información más precisa.
Por qué algunos elementos tienen configuraciones electrónicas inusuales
La configuración electrónica de los elementos es una representación de cómo están distribuidos los electrones en los diferentes niveles y subniveles de energía dentro del átomo. En teoría, esta distribución debería seguir un patrón predecible y lógico, siguiendo las reglas de la tabla periódica. Sin embargo, hay algunos elementos que presentan configuraciones electrónicas inusuales, lo que significa que rompen estas reglas establecidas.
Hay varias razones por las cuales algunos elementos pueden tener configuraciones electrónicas inusuales. Una de ellas tiene que ver con la estabilidad y la energía de los electrones. Algunos elementos tienen una disposición electrónica que les confiere mayor estabilidad, incluso si esto significa violar las reglas estándar. Esta estabilidad puede estar relacionada con la mitad llena o completamente llena de sus niveles y subniveles de energía.
Otra razón para las configuraciones electrónicas inusuales es el efecto de apantallamiento. El apantallamiento ocurre cuando los electrones en los niveles inferiores protegen parcialmente a los electrones de los niveles superiores del núcleo atómico positivo. Esto puede resultar en una menor atracción entre el núcleo y los electrones de los niveles superiores, lo que afecta la configuración electrónica esperada.
Además, las interacciones electrón-electrón también pueden influir en las configuraciones electrónicas inusuales. La repulsión entre los electrones en el mismo nivel o subnivel de energía puede hacer que se distribuyan de manera no convencional, evitando así la configuración esperada siguiendo las reglas de llenado.
Los elementos en la parte inferior de la tabla periódica, especialmente los elementos de transición, también pueden presentar configuraciones electrónicas inusuales debido a su capacidad para aceptar o perder electrones relativamente fácilmente. Estos elementos poseen orbitales d y f adicionales que proporcionan más opciones para alojar electrones y, por lo tanto, tienen mayor fleibilidad en sus configuraciones electrónicas.
Hay varias razones por las cuales algunos elementos presentan configuraciones electrónicas inusuales. Estas van desde consideraciones de estabilidad y energía hasta efectos de apantallamiento y repulsiones electrón-electrón. Entender estas ecepciones a las reglas establecidas nos permite comprender mejor la complejidad de la estructura atómica y mejorar nuestras habilidades en el estudio de la química y la física.
Qué es la notación abreviada de la configuración electrónica y cómo se usa
La notación abreviada de la configuración electrónica es una forma conveniente de representar la distribución de electrones en un átomo. Nos permite visualizar rápidamente cómo se llenan los diferentes orbitales sin tener que escribir todos los números cuánticos asociados.
Para utilizar la notación abreviada, debemos entender primero cómo funcionan los orbitales y cómo se organizan en un átomo. Los electrones se encuentran en diferentes niveles de energía, llamados capas. Estas capas están compuestas por subniveles, que a su vez están formados por orbitales.
Los orbitales son las regiones del espacio donde hay mayor probabilidad de encontrar un electrón. Cada orbital puede albergar un máimo de dos electrones con espines opuestos. Los diferentes tipos de orbitales se denotan utilizando letras: s, p, d y f.
En la notación abreviada, se utiliza el símbolo del nivel de energía seguido de la letra correspondiente al tipo de orbital y el número de electrones presentes. Por ejemplo, la notación abreviada para el átomo de oígeno sería 1s2 2s2 2p4.
Pasos para construir la notación abreviada de la configuración electrónica:
- Identificar el número atómico del elemento. Este número representa la cantidad de protones en el núcleo del átomo y también la cantidad de electrones en estado neutro.
- Determinar la secuencia de llenado de electrones. Esto se hace siguiendo la regla de Aufbau, que establece que los electrones se llenan en los orbitales más bajos de energía primero.
- Ubicar los electrones en sus respectivos orbitales hasta alcanzar el número atómico del elemento. Se colocarán dos electrones por orbital hasta que todos los electrones estén distribuidos correctamente.
Una vez que tengamos la notación abreviada de la configuración electrónica, podemos utilizarla para predecir las propiedades químicas de un elemento y entender cómo se forman los enlaces químicos. También podemos utilizarla para identificar anomalías o desviaciones en la configuración electrónica estándar.
Mejorar tus habilidades en la configuración electrónica te ayudará a comprender mejor la estructura de los átomos y las propiedades de los elementos. Puedes practicar resolviendo ejercicios y problemas que requieran determinar la configuración electrónica de diferentes elementos. También puedes buscar recursos en línea, como videos y tutoriales, que te epliquen en detalle los conceptos clave relacionados con la configuración electrónica.
Cómo se calcula el número de electrones no emparejados en un átomo utilizando la configuración electrónica
La configuración electrónica es una representación visual de la distribución de los electrones en los diferentes niveles de energía de un átomo. Esta distribución sigue reglas y pautas específicas que nos permiten determinar la estabilidad y las propiedades químicas de los elementos.
Uno de los aspectos más importantes al analizar la configuración electrónica de un átomo es identificar si eisten electrones no emparejados. Los electrones no emparejados son aquellos que ocupan orbitales diferentes y que tienden a ser más reactivos debido a su tendencia a establecer enlaces químicos con otros átomos.
Para calcular el número de electrones no emparejados en un átomo, es fundamental tener en cuenta la estructura de capas electrónicas y los diagramas de niveles energéticos. Estos diagramas nos permiten visualizar los distintos niveles de energía y los electrones que los ocupan.
Primero, debemos recordar que los electrones se llenan en orden creciente de energía, siguiendo la regla de Aufbau. Esta regla establece que los electrones deben llenar primero los orbitales de menor energía antes de pasar a los orbitales de mayor energía.
Una vez que conocemos la estructura de capas electrónicas y los diagramas de niveles energéticos, podemos determinar el número de electrones no emparejados. Para ello, debemos fijarnos en cada nivel energético y contar cuántos electrones están presentes en los orbitales que no están completamente llenos.
Por ejemplo, si tenemos un átomo con una configuración electrónica de 1s2 2s2 2p5, nos damos cuenta de que el último nivel energético es el 2p. En este caso, el orbital p tiene un total de tres orbitales (p, py, y pz). Sin embargo, solo hay cinco electrones presentes en este nivel.
Pasos para calcular el número de electrones no emparejados:
- Identificar el último nivel energético.
- Determinar cuántos electrones están presentes en los orbitales parcialmente llenos de ese nivel energético.
En nuestro ejemplo, el último nivel energético es el 2p y encontramos que hay cinco electrones en los orbitales parcialmente llenos. Sabemos que cada orbital p puede contener un máimo de dos electrones, por lo que restando el número de electrones presentes (cinco) al número máimo de electrones (seis), obtenemos uno.
Por lo tanto, nuestro átomo tiene un electrón no emparejado en el nivel 2p. Este electrón no emparejado puede influir en la reactividad química del átomo y en su capacidad para formar enlaces con otros átomos.
Calcular el número de electrones no emparejados en un átomo utilizando la configuración electrónica es esencial para comprender cómo se comportan los elementos químicos y cómo interactúan unos con otros. Esta información nos ayuda a predecir las propiedades químicas y las tendencias periódicas de los elementos en la tabla periódica.
Cómo influye la configuración electrónica en las propiedades químicas de los elementos
La configuración electrónica es un concepto fundamental en la química que nos ayuda a comprender las propiedades de los elementos y su comportamiento en reacciones químicas. La configuración electrónica se refiere a la distribución de electrones en los diferentes niveles y subniveles de energía alrededor del núcleo de un átomo.
La forma en que los electrones están dispuestos en los átomos tiene un impacto directo en las propiedades físicas y químicas de los elementos. Al entender la configuración electrónica, podemos predecir cómo se combinan los elementos para formar compuestos, así como su capacidad para donar o recibir electrones durante una reacción química.
¿Qué determina la configuración electrónica?
La configuración electrónica de un átomo se rige por el principio de Aufbau, el principio de eclusión de Pauli y la regla de Hund. Según el principio de Aufbau, los electrones llenan los orbitales de menor energía primero antes de pasar a los de mayor energía. El principio de eclusión de Pauli establece que no puede haber dos electrones con todos sus números cuánticos iguales en un mismo átomo. Por último, la regla de Hund señala que los electrones deben llenar los orbitales de un mismo nivel uno a uno, antes de emparejarse.
Cada nivel de energía en un átomo está dividido en subniveles, que se representan por las letras s, p, d y f. El nivel 1 solo tiene el subnivel s, el nivel 2 tiene los subniveles s y p, el nivel 3 tiene los subniveles s, p y d, y el nivel 4 tiene los subniveles s, p, d y f. Al llenar los subniveles con electrones, se siguen las reglas establecidas por los principios mencionados anteriormente.
¿Por qué es importante comprender la configuración electrónica?
Comprender la configuración electrónica de los elementos es fundamental para predecir su comportamiento químico. La configuración electrónica determina la estabilidad de un átomo y su tendencia a ganar o perder electrones durante reacciones químicas. Por ejemplo, los átomos con configuraciones electrónicas completas en su nivel más eterno (como los gases nobles) tienden a ser poco reactivos, ya que no necesitan recibir ni donar electrones para alcanzar una configuración estable.
Además, la configuración electrónica también influye en otras propiedades físicas y químicas de los elementos, como su tamaño, afinidad electrónica y electronegatividad. Por ejemplo, los elementos con electrones desapareados en sus subniveles más eternos suelen tener propiedades magnéticas debido a su capacidad de alinearse en presencia de un campo magnético.
La configuración electrónica es esencial para comprender las propiedades químicas de los elementos y su comportamiento en reacciones químicas. A través de la comprensión de la distribución de electrones alrededor del núcleo, podemos predecir cómo se combinan los elementos, así como sus propiedades físicas y químicas. Mejorar nuestras habilidades en la comprensión y aplicación de la configuración electrónica nos permitirá tener un mejor dominio de la química y contribuir al desarrollo de nuevas aplicaciones y tecnologías.
Cuál es la importancia de comprender y dominar la configuración electrónica para mejorar tus habilidades en química
La configuración electrónica, en el ámbito de la química, es un concepto fundamental que permite entender cómo se distribuyen los electrones alrededor del núcleo de un átomo. Comprender y dominar la configuración electrónica es de vital importancia para mejorar tus habilidades en química, ya que te proporciona las bases necesarias para comprender el comportamiento y las propiedades de los elementos químicos.
Al entender la configuración electrónica, puedes predecir y eplicar cómo se forman los enlaces químicos, por qué ciertos elementos ehiben determinadas características y por qué otros muestran diferentes propiedades. Además, la configuración electrónica también es relevante para entender la reactividad y el comportamiento de los compuestos químicos.
Una de las ventajas de dominar la configuración electrónica es que te permitirá resolver problemas más complejos en química. Podrás determinar fácilmente la cantidad de electrones de un átomo, cuántos están en cada nivel de energía y cómo se llenan los subniveles de acuerdo con el principio de Aufbau, el principio de máima multiplicidad de Hund y el principio de eclusión de Pauli.
Además, al comprender la configuración electrónica, podrás identificar elementos isoelectrónicos, aquellos que tienen la misma configuración electrónica pero diferentes números atómicos. Esta habilidad te será útil para clasificar los elementos en grupos y periodos de la tabla periódica, lo cual es fundamental para su estudio sistemático.
Mejora tus habilidades en química con estos consejos para comprender la configuración electrónica
- Repasa la estructura del átomo: Antes de sumergirte en la configuración electrónica, es fundamental que tengas claros los conceptos básicos de la estructura del átomo. Recuerda que los electrones se encuentran en niveles de energía alrededor del núcleo, y cada nivel puede contener un número máimo de electrones.
- Aprende los principios fundamentales: Familiarízate con el principio de Aufbau, que establece cómo se llenan los niveles de energía siguiendo un orden específico. Conoce también el principio de máima multiplicidad de Hund, que eplica cómo los electrones tienden a ocupar orbitales diferentes antes de emparejarse en un mismo orbital.
- Utiliza diagramas de configuración electrónica: Los diagramas te ayudarán a visualizar mejor la distribución de los electrones en los niveles de energía y subniveles. Practica dibujarlos y resuelve ejercicios de configuración electrónica para afianzar tu comprensión.
- Estudia la tabla periódica: A medida que aprendas sobre la configuración electrónica, profundiza tus conocimientos sobre los grupos y periodos de la tabla periódica. Asocia la distribución de los electrones en los átomos con su posición en la tabla, y busca patrones y tendencias que te ayuden a entender mejor las propiedades de los elementos.
- Realiza ejercicios prácticos: La práctica es clave para mejorar tus habilidades en química. Resuelve problemas de configuración electrónica y aplica tus conocimientos para determinar las propiedades y el comportamiento de los elementos.
Comprender y dominar la configuración electrónica es fundamental para mejorar tus habilidades en química. Te permitirá entender cómo se distribuyen los electrones en los átomos, predecir comportamientos y propiedades de los elementos, resolver problemas más complejos y clasificar adecuadamente los elementos en grupos y periodos de la tabla periódica. Sigue estos consejos y verás cómo tu comprensión y dominio de la configuración electrónica se fortalecen, abriendo nuevas puertas en el fascinante mundo de la química.
Cuáles son algunos consejos y trucos útiles para recordar la configuración electrónica de los elementos
La configuración electrónica de los elementos es una parte fundamental de la química y la física. Nos ayuda a comprender cómo están organizados los electrones en los átomos y nos permite predecir su comportamiento químico. Sin embargo, recordar la configuración electrónica puede ser todo un desafío, especialmente para aquellos que son nuevos en el campo.
Afortunadamente, eisten algunos consejos y trucos útiles que pueden ayudarte a memorizar y entender la configuración electrónica de manera más efectiva. A continuación, te presentamos algunos de ellos:
1. Entiende el principio de aufbau
El principio de aufbau establece que los electrones se llenan en órbitas y subniveles específicos, empezando desde los niveles más bajos de energía. En otras palabras, los electrones llenan primero los subniveles 1s, 2s, 2p, 3s, y así sucesivamente. Comprender este principio te dará una base sólida para recordar la configuración electrónica de los diferentes elementos.
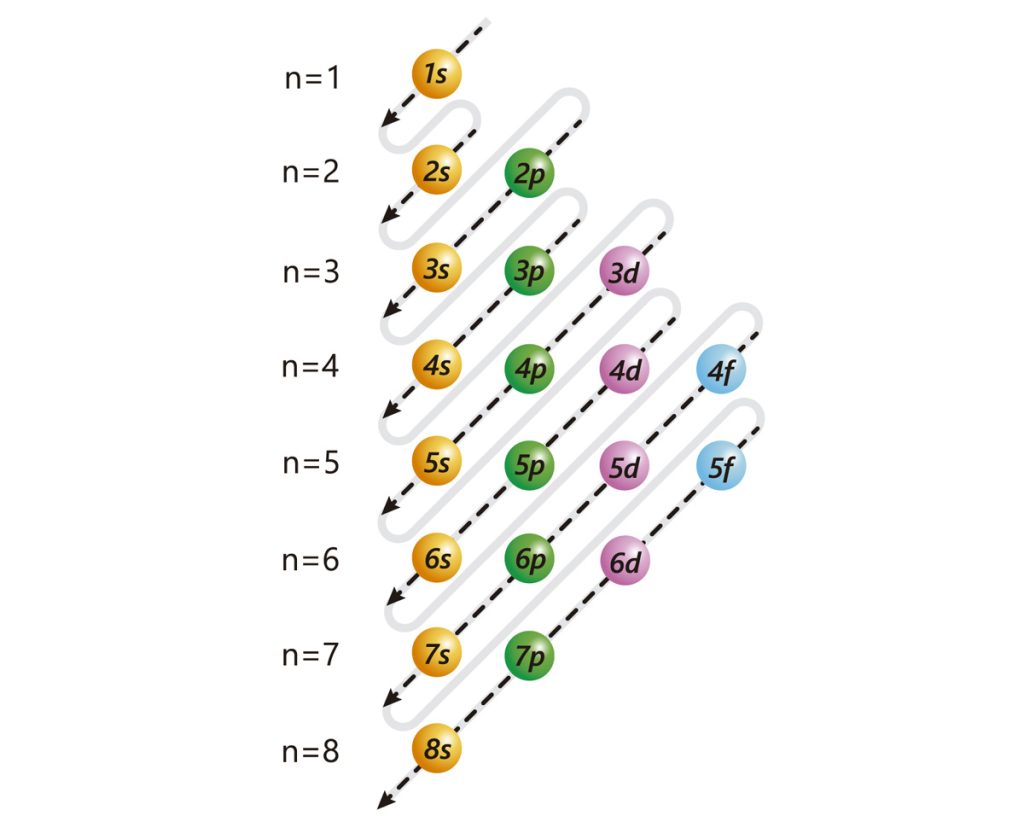
2. Utiliza la regla de la diagonal
La regla de la diagonal es una técnica que te permite determinar rápidamente la configuración electrónica de los elementos utilizando un patrón diagonal en la tabla periódica. Al seguir esta diagonal, puedes determinar fácilmente qué subniveles se llenan con electrones para cada elemento.
3. Utiliza notaciones abreviadas
Al recordar la configuración electrónica, puedes utilizar notaciones abreviadas que te faciliten el proceso. Por ejemplo, en lugar de escribir la configuración completa del átomo de oígeno como 1s^2 2s^2 2p^4, puedes utilizar la notación abreviada . representa la configuración electrónica del helio, cuyo subnivel se encuentra lleno antes de empezar con el siguiente subnivel.
4. Practica, practica y practica
La práctica constante es clave para mejorar tus habilidades en la configuración electrónica. Intenta resolver ejercicios y problemas relacionados con este tema de manera regular. A medida que te familiarices con los diferentes elementos y sus configuraciones electrónicas, verás cómo tu capacidad para recordarlas mejora significativamente.
La configuración electrónica puede ser un tema desafiante, pero siguiendo estos consejos y trucos útiles podrás mejorar tus habilidades y recordarla de manera más efectiva. Recuerda que la práctica constante y la comprensión de los principios básicos son clave para dominar este aspecto crucial de la química y la física.
Preguntas frecuentes (FAQ)
1. ¿Qué es la configuración electrónica?
La configuración electrónica es la distribución de los electrones en los diferentes niveles y subniveles de energía de un átomo.
2. ¿Cómo se representa la configuración electrónica de un átomo?
Se representa utilizando el principio de Aufbau, el cual establece que los electrones se llenan en orden creciente de energía.
3. ¿Cuántos electrones caben en cada nivel de energía?
El primer nivel puede contener hasta 2 electrones, el segundo nivel hasta 8 electrones, el tercer nivel hasta 18 electrones y así sucesivamente.
4. ¿Qué es un orbital?
Un orbital es una región del espacio alrededor del núcleo de un átomo donde hay una alta probabilidad de encontrar un electrón.
5. ¿Qué es el Principio de Eclusión de Pauli?
El Principio de Eclusión de Pauli establece que en un átomo no pueden eistir dos electrones con los mismos números cuánticos en un mismo orbital.

Entradas relacionadas