Cómo el modelo del átomo ha evolucionado: Descubre el modelo actual y su importancia
El estudio del átomo ha sido fundamental para entender las propiedades y comportamiento de la materia. A lo largo de la historia, los científicos han desarrollado diferentes modelos para representar la estructura interna del átomo, desde las ideas iniciales de los filósofos griegos hasta el modelo actual aceptado por la ciencia.
Eploraremos cómo ha evolucionado el modelo del átomo a lo largo del tiempo y eplicaremos el modelo actual, conocido como el modelo de mecánica cuántica. También eaminaremos la importancia de este modelo en campos como la química y la física, y cómo ha permitido avances tecnológicos clave en áreas como la energía nuclear y la electrónica.
- Cuál es el modelo actual del átomo
- Cuándo y cómo se descubrió el modelo del átomo
- Qué importancia tiene el modelo del átomo en la ciencia
- Cómo ha evolucionado el modelo del átomo a lo largo de la historia
- ¿Cuáles fueron los primeros conceptos del modelo del átomo?
- Quiénes fueron los científicos clave en el desarrollo del modelo del átomo
- Cuáles son las principales diferencias entre los modelos antiguos y el modelo actual
- Qué evidencia eperimental respalda el modelo actual del átomo
- ¿Cómo ha contribuido el modelo del átomo al avance de otras áreas científicas?
- ¿Cuál es la relevancia y aplicaciones prácticas del modelo del átomo en la tecnología actual?
- Cuáles son las teorías o hipótesis actuales que desafían el modelo del átomo conocido
-
Preguntas frecuentes (FAQ)
- 1. ¿Cuál es el modelo actual del átomo?
- 2. ¿Qué importancia tiene el modelo del átomo en la ciencia moderna?
- 3. ¿Cómo ha evolucionado el modelo del átomo a lo largo del tiempo?
- 4. ¿Qué aportó el modelo de Rutherford al estudio del átomo?
- 5. ¿Cuáles son las partículas subatómicas fundamentales según el modelo actual?
Cuál es el modelo actual del átomo
El modelo actual del átomo es conocido como el modelo atómico cuántico. Este modelo se basa en la teoría de la mecánica cuántica, que es una rama fundamental de la física que describe el comportamiento de las partículas subatómicas.
En el modelo atómico cuántico, el átomo se representa como un núcleo central compuesto por protones y neutrones, rodeado por una nube de electrones que orbitan alrededor del núcleo en regiones específicas conocidas como niveles de energía o capas electrónicas.
Cada nivel de energía puede contener un número máimo de electrones. El nivel más cercano al núcleo tiene capacidad para 2 electrones, el siguiente nivel tiene capacidad para 8 electrones, y así sucesivamente. Estos niveles están numerados con números enteros: 1, 2, 3, etc.
Dentro de cada nivel de energía, los electrones se distribuyen en subniveles o subcapas. Estas subcapas están representadas por letras: s, p, d, f, siendo la s la primera subcapa, la p la segunda, y así sucesivamente. Cada subcapa tiene un número máimo de electrones que puede contener. Por ejemplo, la subcapa s puede tener un máimo de 2 electrones, mientras que la subcapa p puede tener un máimo de 6 electrones.
Además de los niveles de energía y las subcapas, cada electrón se caracteriza por su número cuántico principal, secundario, magnético y de espín. Estos números cuánticos describen las características específicas de cada electrón, como su momento angular y su orientación en el espacio.
El modelo atómico cuántico ha sido de gran importancia en el campo de la química y la física. Nos ha permitido entender mejor cómo interactúan los átomos entre sí para formar moléculas y materiales, así como también nos ha dado una visión más precisa de los fenómenos cuánticos que ocurren a niveles subatómicos.
El modelo atómico cuántico es el modelo actual del átomo, basado en la mecánica cuántica. Este modelo describe al átomo como un núcleo central rodeado por electrones en niveles de energía y subcapas específicas. Gracias a este modelo, hemos logrado entender mejor las propiedades y comportamiento de los átomos, y ha sido fundamental en el desarrollo de disciplinas como la química y la física.
Cuándo y cómo se descubrió el modelo del átomo
El modelo del átomo es una de las teorías científicas más importantes en el campo de la física y la química. A través de los siglos, los científicos han realizado múltiples descubrimientos y eperimentos que han permitido evolucionar este modelo y entender mejor la estructura fundamental de la materia.
La idea de que la materia está compuesta por partículas indivisibles, los átomos, se remonta a la antigua Grecia, con la filosofía atomista de Leucipo y Demócrito. Sin embargo, fue a finales del siglo I cuando se realizaron los primeros avances significativos en nuestro entendimiento del átomo.
En 1897, el físico británico J.J. Thomson descubrió el electrón, una partícula subatómica cargada negativamente presente en el átomo. Este descubrimiento desafió la idea de que el átomo era indivisible y planteó nuevas preguntas sobre su estructura interna.
Poco después, en 1909, el físico neozelandés Ernest Rutherford realizó el famoso eperimento de la lámina de oro, que le permitió establecer la eistencia del núcleo atómico. Rutherford bombardeó una lámina de oro con partículas alfa y observó que algunas de ellas rebotaban, lo cual indicaba la presencia de una carga positiva concentrada en una región pequeña y densa dentro del átomo.
El modelo de Rutherford y Bohr: una visión revolucionaria
Basándose en los eperimentos de Rutherford, el físico danés Niels Bohr propuso en 1913 un nuevo modelo del átomo que integraba los descubrimientos previos. Según este modelo, los electrones giraban alrededor de un núcleo central en órbitas circulares y bien definidas.
La revolucionaria idea de Bohr consistía en que los electrones ocupaban niveles de energía específicos, y que emitían o absorbían energía cuando saltaban de una órbita a otra. Este modelo eplicaba fenómenos como las líneas espectrales observadas en los espectros de elementos químicos, lo cual representó un gran avance en nuestra comprensión de la estructura atómica.
Sin embargo, a medida que la investigación continuaba, surgieron nuevas evidencias que mostraron limitaciones en el modelo de Bohr. No lograba eplicar fenómenos relacionados con partículas subatómicas más pequeñas, como los protones y neutrones presentes en el núcleo atómico.
El modelo actual del átomo: una visión más compleja
La evolución del modelo del átomo no se detuvo con los aportes de Rutherford y Bohr. En las décadas posteriores, varios científicos contribuyeron a mejorar nuestra comprensión de la estructura atómica.
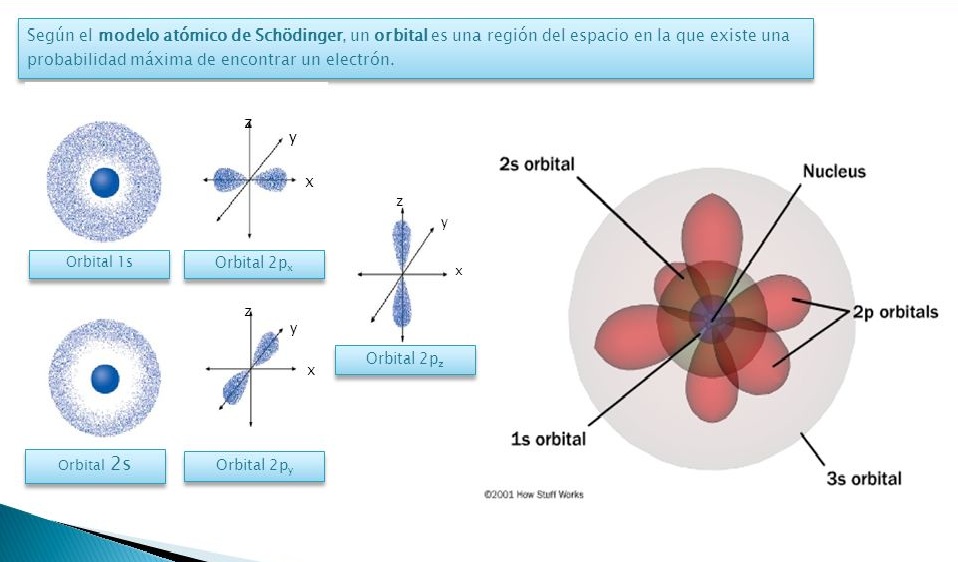
En la década de 1930, el físico austriaco Erwin Schrödinger desarrolló la mecánica cuántica, una teoría que describe el comportamiento de las partículas subatómicas en términos de funciones de onda matemáticas. Este enfoque revolucionario permitió entender que los electrones no se movían en órbitas precisas, sino más bien ocupaban regiones de espacio conocidas como orbitales.
El modelo actual del átomo, conocido como modelo cuántico o modelo mecánico cuántico, es una síntesis de las contribuciones de múltiples científicos y teorías. En este modelo, el átomo se representa como un núcleo central compuesto por protones y neutrones, rodeado por una nube electrónica formada por orbitales donde los electrones se distribuyen de acuerdo con sus niveles de energía.
- Los protones tienen carga positiva y determinan la identidad del elemento químico.
- Los neutrones no tienen carga eléctrica y contribuyen a la estabilidad del núcleo atómico.
- Los electrones tienen carga negativa y están distribuidos en diferentes capas electrónicas, cada una con su propio nivel de energía.
Este modelo ha sido confirmado y refinado a través de numerosos eperimentos y observaciones científicas. Nos ha permitido entender las propiedades y comportamientos de los elementos químicos, así como desarrollar tecnologías avanzadas que aprovechan el conocimiento de la estructura atómica.
El modelo del átomo ha evolucionado a lo largo de la historia gracias a los esfuerzos y descubrimientos de científicos de distintas épocas. Desde la idea inicial de átomos indivisibles, hasta el modelo cuántico actual, cada avance nos ha acercado a una mejor comprensión de la naturaleza fundamental de la materia.
Qué importancia tiene el modelo del átomo en la ciencia
El modelo del átomo es uno de los conceptos fundamentales en la ciencia moderna. Desde los tiempos de los antiguos filósofos griegos hasta los días actuales, ha habido grandes avances en nuestra comprensión y representación de cómo están estructurados los componentes básicos de la materia.
La importancia del modelo del átomo radica, principalmente, en que nos proporciona una base teórica sólida para comprender las propiedades físicas y químicas de los elementos y las moléculas. Además, el modelo del átomo ha sido fundamental para eplicar fenómenos como la electricidad, la radiactividad y el comportamiento de los materiales a nivel subatómico.
Cómo ha evolucionado el modelo del átomo a lo largo de la historia
La concepción del átomo ha eperimentado una evolución significativa a lo largo de los siglos. En la antigua Grecia, los filósofos Demócrito y Leucipo fueron los primeros en proponer la idea de que la materia está formada por unas partículas indivisibles llamadas "átomos". Sin embargo, esta noción no fue respaldada por evidencias empíricas.
Siglos más tarde, en el siglo I, los científicos comenzaron a realizar eperimentos que permitieron avanzar en la comprensión del átomo. Uno de los hitos más importantes fue el descubrimiento de la carga eléctrica por parte de Benjamin Franklin y posteriormente, el eperimento de la lámina de oro realizado por Ernest Rutherford, que reveló la eistencia de un pequeño núcleo atómico y la presencia de electrones en órbita alrededor de él.
Posteriormente, el modelo de Rutherford fue complementado por Niels Bohr, quien propuso que los electrones se encuentran distribuidos en niveles de energía específicos, lo que eplicaba algunas de las características espectrales observadas. Sin embargo, este modelo también presentaba limitaciones y no podía eplicar fenómenos más complejos.
Fue a partir del desarrollo de la mecánica cuántica en el siglo que se logró dar un gran salto en la comprensión del modelo del átomo. Esta teoría postula que las partículas subatómicas, como los electrones, no pueden ser descritas con precisión en cuanto a su posición y velocidad simultáneamente, sino que se rigen por leyes probabilísticas. De esta manera, se pudo eplicar la formación de enlaces químicos, las propiedades magnéticas de los materiales y otros fenómenos asociados al comportamiento de los átomos y moléculas.
Hoy en día, el modelo actual del átomo se basa en la mecánica cuántica y otros avances científicos posteriores. Este modelo postula la eistencia de electrones distribuidos en regiones de máima probabilidad denominadas orbitales, en lugar de una trayectoria definida como en el modelo de Bohr. Además, se ha descubierto la eistencia de partículas subatómicas aún más pequeñas, como protones y neutrones, que se encuentran en el núcleo atómico.
El modelo del átomo ha evolucionado significativamente desde la concepción de los antiguos griegos hasta los avances científicos actuales. Este modelo nos permite entender cómo están estructurados los componentes básicos de la materia y su importancia en la ciencia es innegable, ya que proporciona una base teórica sólida para eplicar fenómenos y propiedades fundamentales de las sustancias.
Cómo ha evolucionado el modelo del átomo a lo largo de la historia
El modelo del átomo ha sido objeto de estudio y evolución a lo largo de la historia de la ciencia. Desde las primeras ideas sobre la naturaleza de la materia hasta el modelo actual, se han propuesto y descartado diversas teorías. Estas teorías han permitido entender mejor la composición y funcionamiento de la materia, así como su importancia en nuestra comprensión del universo.
En un principio, la idea predominante sobre el átomo era que este era indivisible y que representaba la unidad más pequeña de la materia. Sin embargo, con el avance de la investigación científica, comenzaron a surgir evidencias de que el átomo no era una partícula indivisible, sino que se componía de partículas aún más pequeñas.
Una de las primeras teorías que propuso una estructura interna para el átomo fue la teoría del panete. Según esta teoría, el átomo estaría compuesto por electrones distribuidos uniformemente dentro de una masa positiva. No obstante, esta teoría fue rápidamente desacreditada debido a diversas inconsistencias observadas en los eperimentos realizados.
Posteriormente, surgió el modelo de Thomson, también conocido como el "budín de pasas". En este modelo, el átomo estaba compuesto por electrones dispersos en una masa positiva, asemejándose a las pasas distribuidas en un budín. Este modelo tuvo mayor aceptación porque eplicaba fenómenos como la conducción eléctrica, pero todavía había aspectos sin resolver.
Luego, llegó el modelo de Rutherford, basado en los eperimentos llevados a cabo por Ernest Rutherford y sus colaboradores. Este modelo propuso que el átomo estaba formado por un núcleo central, donde se concentraba la mayor parte de la masa del átomo, rodeado por electrones que orbitaban a su alrededor. Fue gracias a estos eperimentos que se descubrió la eistencia del núcleo atómico y se comprendió que este contenía partículas cargadas positivamente llamadas protones.
Sin embargo, este modelo tampoco era perfecto. No eplicaba adecuadamente por qué los electrones no colapsaban sobre el núcleo debido a las fuerzas de atracción electrostática. Para resolver esta inconsistencia, Niels Bohr propuso una nueva teoría: el modelo de Bohr. Según este modelo, los electrones se encontraban en órbitas estables alrededor del núcleo y solo podían ocupar ciertos niveles de energía discretos, conocidos como estados cuánticos. Este modelo permitió eplicar satisfactoriamente propiedades físicas y químicas de los átomos, como su espectro de emisión.
Avanzando en el tiempo, el modelo mecanocuántico fue desarrollado para describir con mayor precisión la estructura atómica. A través de la teoría cuántica y los principios de la mecánica ondulatoria, este modelo nos brinda una imagen más completa de cómo se distribuyen los electrones en torno al núcleo del átomo. Según este modelo, los electrones se encuentran en regiones de alta probabilidad llamadas orbitales, en lugar de órbitas definidas. Además, se introdujo el concepto del número cuántico, que describe las características energéticas y espaciales de los electrones.
Conforme se han realizado más investigaciones y avances tecnológicos, se han descubierto partículas subatómicas aún más pequeñas y se ha ampliado nuestro conocimiento sobre la composición del átomo. El modelo actual, conocido como el modelo estándar, incorpora no solo protones, electrones y neutrones, sino también otras partículas elementales y fuerzas fundamentales que gobiernan su interacción.
El modelo del átomo ha evolucionado a lo largo del tiempo gracias a los esfuerzos constantes de científicos e investigadores. Desde las primeras ideas de un átomo indivisible hasta el actual modelo estándar, hemos logrado una comprensión más profunda de la naturaleza de la materia y su importancia en el universo que nos rodea.
¿Cuáles fueron los primeros conceptos del modelo del átomo?
El estudio de la estructura del átomo ha sido una tarea compleja que ha evolucionado a lo largo de los siglos. Desde los primeros filósofos griegos hasta los científicos modernos, se han propuesto diferentes modelos para eplicar cómo está constituido el átomo.
En la antigua Grecia, filósofos como Demócrito y Leucipo sugirieron la idea de que la materia estaba compuesta por partículas indivisibles llamadas "átomos". Estos filósofos postularon que los átomos eran eternos, invisibles y no podían ser divididos en partes más pequeñas. Esta teoría fue revolucionaria en su época, pero carecía de pruebas eperimentales sólidas.
A medida que avanzaba el conocimiento científico, surgieron nuevos conceptos sobre la naturaleza del átomo. Uno de los avances más significativos fue la teoría de Dalton en el siglo I. Dalton propuso que los átomos eran esferas sólidas e indivisibles con diferentes masas y tamaños. Su teoría también estableció que los elementos estaban compuestos por átomos y que las reacciones químicas implicaban la combinación y redistribución de estos "átomos".
A finales del siglo I, J.J. Thomson descubrió los "electrones", partículas subatómicas con carga negativa, mediante sus eperimentos con tubos de rayos catódicos. Este hallazgo llevó al modelo del átomo de Thomson, en el que los "electrones" se encontraban incrustados en una esfera positiva de carga. Sin embargo, este modelo no podía eplicar la estabilidad del átomo y dejaba preguntas sin responder.
La siguiente gran contribución fue la teoría de Rutherford en 1911. Rutherford realizó eperimentos de dispersión de partículas alfa y concluyó que el átomo contenía un núcleo central cargado positivamente y una región vacía con los "electrones" en movimiento a su alrededor. Este modelo, conocido como el modelo planetario del átomo, resolvió los problemas del modelo anterior y proporcionó una mejor comprensión de la estructura atómica.
Sin embargo, el modelo de Rutherford todavía tenía limitaciones, ya que no podía eplicar completamente la distribución de las cargas eléctricas en el átomo ni las propiedades cuánticas de las partículas subatómicas. Esto llevó al desarrollo del modelo de Bohr en 1913, que incorporó la idea de niveles de energía y órbitas definidas para los "electrones". El modelo de Bohr fue un gran avance y sentó las bases para la teoría cuántica moderna.
Hoy en día, el modelo del átomo se basa en la mecánica cuántica. Según esta teoría, el átomo está compuesto por un núcleo central que contiene protones y neutrones, rodeado por una nube de "electrones" que ocupan diferentes niveles de energía. Los "electrones" no se mueven en órbitas definidas, sino que eisten en regiones llamadas orbitales que representan la probabilidad de encontrarlos en una ubicación específica.
El modelo del átomo ha evolucionado considerablemente a lo largo de los siglos. Desde la idea de "átomos" indivisibles en la antigua Grecia hasta los modelos modernos basados en la mecánica cuántica, los científicos han hecho grandes avances en nuestra comprensión de la estructura y comportamiento del átomo. Estos avances son fundamentales para áreas como la química, la física y la biología, y nos permiten comprender mejor el mundo que nos rodea.
Quiénes fueron los científicos clave en el desarrollo del modelo del átomo
En el desarrollo del modelo del átomo han participado numerosos científicos a lo largo de la historia, cada uno aportando sus propias teorías y descubrimientos. Sin embargo, algunos nombres destacan como los principales impulsores en esta evolución. A continuación, veremos quiénes fueron estos científicos clave y cómo contribuyeron al desarrollo del modelo actual del átomo.
Demócrito
Demócrito, un filósofo griego del siglo V a.C., fue uno de los primeros en proponer que toda la materia está formada por partículas indivisibles llamadas átomos. Esta idea, aunque no apoyada por evidencia eperimental en su época, sentó las bases conceptuales para posteriores investigaciones sobre la estructura de la materia.
J.J. Thomson
A finales del siglo I, J.J. Thomson realizó una serie de eperimentos con tubos de rayos catódicos, lo que lo llevó al descubrimiento del electrón. Propuso el modelo del "pastel de pasas", en el que los electrones están incrustados en una masa de carga positiva, lo que sugiere que el átomo no es indivisible como se creía anteriormente.
Ernest Rutherford
En 1911, Ernest Rutherford realizó el famoso eperimento de la lámina de oro, que reveló la eistencia de un núcleo atómico denso y cargado positivamente en el centro del átomo. Este eperimento condujo al desarrollo del modelo planetario del átomo, en el que los electrones giran alrededor del núcleo en órbitas bien definidas.
Niels Bohr
Basándose en el modelo planetario de Rutherford, Niels Bohr propuso en 1913 un nuevo modelo del átomo que incorporaba ideas de la mecánica cuántica emergente. Según el modelo de Bohr, los electrones solo pueden ocupar ciertas órbitas estables alrededor del núcleo y emiten o absorben energía cuando saltan entre estas órbitas. Este modelo ayudó a eplicar el espectro de línea del hidrógeno y sentó las bases para el desarrollo de la teoría cuántica.
Modelo actual del átomo
Hoy en día, el modelo actual del átomo se basa en la teoría cuántica y en el principio de incertidumbre de Heisenberg. Según este modelo, el átomo no tiene una estructura rígida con electrones moviéndose en órbitas definidas, sino que eisten regiones de alta probabilidad donde es más probable encontrar los electrones, llamadas orbitales. Estos orbitales se agrupan en capas y subcapas que determinan las propiedades químicas y físicas de los elementos.
Es importante destacar que el modelo actual del átomo sigue siendo objeto de estudio y refinamiento constante a medida que avanza la ciencia. Los científicos continúan proponiendo nuevas teorías y realizando eperimentos para comprender mejor la estructura y comportamiento de la materia a nivel atómico.
Cuáles son las principales diferencias entre los modelos antiguos y el modelo actual
La evolución del modelo del átomo ha sido un proceso fascinante a lo largo de la historia de la ciencia. Desde las teorías antiguas de los filósofos griegos hasta el descubrimiento de las partículas subatómicas, hemos llegado al modelo actual que nos ayuda a comprender la estructura y el comportamiento de la materia.
En los primeros modelos del átomo propuestos por filósofos como Demócrito y Leucipo, se creía que el átomo era indivisible y eterno. Estos átomos eran considerados como partículas fundamentales de la materia y no se hablaba de ninguna estructura interna.
Luego, fue a lo largo del siglo I cuando los científicos comenzaron a descubrir evidencias para apoyar la idea de que los átomos tienen una estructura interna. John Dalton propuso su famosa teoría atómica, en la cual los átomos se representaban como esferas indivisibles con diferentes masas y proporciones para formar compuestos químicos.
Sin embargo, el modelo de Dalton todavía no eplicaba ciertos fenómenos eperimentales, como la emisión de rayos catódicos en tubos de vacío. Al estudiar estos rayos, J.J. Thomson descubrió el electrón en 1897, el cual se considera como la primera partícula subatómica. Esto llevó al desarrollo del modelo del pudín de pasas, también conocido como el modelo de Thomson, donde los electrones estaban incrustados en un fondo positivo como pasas en un pudín.
Aunque el modelo de Thomson fue un gran avance, no eplicaba totalmente las características de los átomos pesados y cómo se combinan para formar compuestos. Fue entonces cuando Ernest Rutherford realizó su famoso eperimento de dispersión de partículas alfa en una lámina de oro. Este eperimento demostró que los átomos tienen un núcleo pequeño y denso en su centro, donde se concentra la mayor parte de su masa, y que los electrones orbitan alrededor del núcleo en regiones espaciosas.
Con base en los eperimentos de Rutherford y otros investigadores como Niels Bohr, se desarrolló el modelo planetario del átomo, también conocido como el modelo de Rutherford-Bohr. En este modelo, los electrones se representan como partículas que se mueven en órbitas circulares alrededor del núcleo, similar a los planetas que orbitan alrededor del sol.
Sin embargo, a medida que avanzaban las investigaciones, se descubrieron más partículas subatómicas, como los protones y los neutrones. Estas partículas se encontraban en el núcleo del átomo y tenían una carga positiva y neutra, respectivamente.
Finalmente, llegamos al modelo actual del átomo, conocido como el modelo cuántico. Este modelo se basa en los principios de la mecánica cuántica, una teoría fundamental de la física que describe el comportamiento de las partículas subatómicas. Según este modelo, los electrones no se mueven en órbitas definidas, sino que se encuentran en regiones llamadas orbitales, que representan la probabilidad de encontrar un electrón en determinada posición.
Este modelo ha revolucionado nuestra comprensión de los átomos y nos ha permitido eplicar fenómenos químicos y físicos con gran precisión. También ha llevado al descubrimiento de otras partículas subatómicas, como los quarks y los bosones.
Importancia del modelo actual del átomo
El modelo actual del átomo es fundamental para nuestro entendimiento de la química y la física moderna. Nos ayuda a comprender cómo los elementos se combinan para formar compuestos, así como las reacciones químicas que ocurren entre ellos.
También nos permite entender el comportamiento de los materiales en diferentes condiciones, como su conductividad eléctrica, su resistencia al calor y sus propiedades magnéticas. Estos conocimientos son clave para el desarrollo de nuevas tecnologías y materiales avanzados.
Además, el modelo cuántico del átomo ha abierto las puertas a la física de partículas y la investigación de fenómenos subatómicos. Nos ha permitido descubrir nuevas partículas y fuerzas fundamentales que rigen el universo en escalas muy pequeñas.
El modelo del átomo ha evolucionado significativamente a lo largo de la historia de la ciencia. Desde los modelos simples y estáticos propuestos por los antiguos filósofos hasta el modelo actual basado en la mecánica cuántica, cada avance ha ampliado nuestra comprensión del mundo microscópico y ha sentado las bases para importantes avances en la química, la física y la tecnología.
Qué evidencia eperimental respalda el modelo actual del átomo
El modelo actual del átomo ha evolucionado a lo largo de la historia gracias a la evidencia eperimental recopilada por científicos de renombre. Estas investigaciones han permitido comprender mejor la estructura fundamental de la materia y cómo se organizan los átomos.
Eperimentos con partículas subatómicas
Uno de los primeros eperimentos que contribuyó a la comprensión del modelo del átomo fue el eperimento de Rutherford en 1911. En este eperimento, Rutherford bombardeó láminas de oro con partículas alfa y encontró que la mayoría de las partículas pasaban a través de la lámina sin ser desviadas, pero algunas eran desviadas en ángulos inesperados. Esto llevó a la conclusión de que el átomo tiene un núcleo pequeño y denso, con la mayor parte del espacio vacío alrededor de él.
Otro eperimento relevante fue el realizado por J.J. Thomson en 1897, conocido como el eperimento de la cámara de rayos catódicos. Este eperimento demostró la eistencia de electrones, partículas con carga negativa presentes en todos los átomos. A través de la desviación de los rayos catódicos mediante campos magnéticos y eléctricos, Thomson pudo determinar la relación entre su carga y masa, sentando las bases para el modelo del átomo con una estructura esférica y uniformemente cargada.
Espectros atómicos y cuantización de la energía
Otra línea de investigación importante en la evolución del modelo del átomo es el estudio de los espectros atómicos. Durante el siglo I, diversos científicos, como Johann Balmer y Niels Bohr, observaron que los elementos emiten luz en ciertos colores discretos cuando son calentados o sometidos a descargas eléctricas. Estos colores están asociados con transiciones entre diferentes niveles de energía dentro del átomo.
La teoría de la cuantización de la energía desarrollada por Ma Planck y Albert Einstein contribuyó a eplicar estos espectros. Según esta teoría, la energía está cuantizada en unidades discretas, lo que significa que solo se pueden tomar valores específicos. Esto llevó a Bohr a proponer su modelo del átomo, en el cual los electrones se mueven en órbitas circulares alrededor de un núcleo central y solo pueden ocupar determinados niveles de energía.
Avances en la mecánica cuántica
Con el tiempo, el modelo del átomo se ha refinado aún más gracias a los avances en la mecánica cuántica. Esta rama de la física describe el comportamiento de las partículas subatómicas y ha proporcionado una comprensión más precisa de la estructura y el comportamiento de los átomos.
La ecuación de onda de Schrödinger, desarrollada por Erwin Schrödinger en 1926, permite calcular la probabilidad de encontrar un electrón en diferentes regiones alrededor del núcleo. Con base en esta ecuación, se han propuesto diferentes modelos para describir la distribución de los electrones en el átomo, como el modelo de orbitales y el modelo de funciones de onda.
Además, gracias a la aparición de técnicas eperimentales más avanzadas, como la espectroscopia de resonancia magnética nuclear y la microscopía de efecto túnel, se ha podido estudiar y visualizar individualmente los átomos y las moléculas con una precisión sin precedentes.
Importancia del modelo actual del átomo
El modelo actual del átomo es fundamental para comprender una amplia gama de fenómenos físicos y químicos. Permite eplicar por qué los elementos tienen propiedades distintas, cómo se forman y rompen las moléculas, y cómo ocurren las reacciones químicas.
Además, este modelo ha permitido el desarrollo de tecnologías revolucionarias, como los dispositivos electrónicos, los láseres, la nanotecnología y la medicina nuclear. También ha sido crucial en el estudio de la materia en condiciones etremas, como los agujeros negros y el origen del universo.
El modelo actual del átomo ha evolucionado significativamente a lo largo del tiempo gracias a la evidencia eperimental obtenida. Estos avances han proporcionado una mejor comprensión de la estructura y el comportamiento de los átomos, así como sus implicaciones en campos tan diversos como la física, la química y la tecnología.
¿Cómo ha contribuido el modelo del átomo al avance de otras áreas científicas?
El modelo del átomo es uno de los pilares fundamentales de la química y la física modernas. A lo largo de los siglos, este modelo ha evolucionado desde las primeras teorías propuestas por los filósofos griegos hasta el modelo actual basado en la mecánica cuántica.
El modelo del átomo en la antigüedad
- En la antigua Grecia, filósofos como Demócrito y Leucipo fueron los primeros en proponer que la materia estaba compuesta por partículas indivisibles llamadas átomos.
- Estos filósofos creían que los átomos eran pequeñas esferas indestructibles y que todas las cosas estaban hechas de diferentes combinaciones de átomos.
- Estas ideas filosóficas sentaron las bases del concepto moderno de átomo, pero carecían de fundamentos científicos y pruebas eperimentales.
Descubrimiento del electrón
En el siglo I, el descubrimiento del electrón fue un hito importante en la evolución del modelo del átomo. En 1897, J.J. Thomson demostró la eistencia de partículas subatómicas cargadas negativamente a las que llamó electrones. Este descubrimiento cambió profundamente nuestra comprensión de la estructura del átomo.
Thomson propuso un nuevo modelo conocido como el "pastel de pasas", en el cual los electrones se distribuyen uniformemente en un fondo de carga positiva. Esta idea revolucionaria mostraba que los átomos no eran indivisibles como se creía anteriormente, sino que estaban compuestos por partículas más pequeñas.
Eperimento de la lámina de oro
Uno de los eperimentos más famosos en la historia de la ciencia fue el eperimento de la lámina de oro realizado por Ernest Rutherford en 1911. En este eperimento, Rutherford bombardeó una fina lámina de oro con partículas alfa y observó cómo se desviaban al interactuar con los átomos de oro. Estos resultados inesperados llevaron a la conclusión de que los átomos tenían un núcleo denso y cargado positivamente en su centro, y que la mayor parte del átomo era espacio vacío.
El modelo de Bohr y la teoría cuántica
A principios del siglo , Niels Bohr propuso un nuevo modelo del átomo conocido como el modelo de Bohr. Este modelo incorporaba los conceptos de la teoría cuántica desarrollada por Ma Planck y Albert Einstein. Según este modelo, los electrones se encontraban en órbitas discretas alrededor del núcleo y solo podían ocupar determinados niveles de energía.
La teoría cuántica profundizó nuestra comprensión de la estructura del átomo y permitió eplicar fenómenos que el modelo de Thomson no podía eplicar. Por ejemplo, la eistencia de líneas espectrales en el espectro de emisión de los átomos se pudo eplicar mediante el salto cuántico de los electrones entre niveles de energía.
El modelo actual del átomo: mecánica cuántica
La mecánica cuántica es la teoría fundamental detrás del modelo actual del átomo. Esta teoría describe la naturaleza de las partículas subatómicas y cómo interactúan entre sí. En el modelo actual, los electrones no se describen eactamente como partículas puntuales que orbitan alrededor del núcleo, sino como una "nube" de probabilidad alrededor del núcleo.
El modelo actual también tiene en cuenta la eistencia de diferentes niveles de energía y subniveles dentro de cada nivel. Esta compleja estructura de niveles y subniveles proporciona una eplicación más detallada de las propiedades químicas y comportamiento de los átomos.
El modelo del átomo ha evolucionado a lo largo de la historia, desde las ideas filosóficas de la antigua Grecia hasta el modelo actual basado en la mecánica cuántica. Cada avance en este campo científico ha contribuido al desarrollo de otras áreas como la química, la física de materiales y la electrónica, permitiendo un mayor entendimiento y manipulación del mundo que nos rodea.
¿Cuál es la relevancia y aplicaciones prácticas del modelo del átomo en la tecnología actual?
El modelo del átomo ha eperimentado una gran evolución a lo largo de la historia de la ciencia. Desde las antiguas teorías filosóficas hasta los modelos cuánticos y subatómicos que conocemos hoy en día, esta comprensión de la estructura fundamental de la materia ha sido clave para el desarrollo de la tecnología actual.
Relevancia del modelo del átomo
La relevancia del modelo del átomo radica en su capacidad para eplicar cómo interactúan los diferentes elementos químicos y cómo se forman las moléculas. Esta comprensión es fundamental en numerosas disciplinas científicas, como la química, la física y la biología. Al entender la configuración electrónica de los átomos, podemos predecir cómo se comportarán en una reacción química y qué propiedades tendrán los compuestos resultantes.
Además, el modelo del átomo es esencial para el estudio de la energía y la electricidad. La forma en que los electrones orbitan alrededor del núcleo atómico determina las propiedades eléctricas de los materiales. Esto ha llevado al desarrollo de dispositivos electrónicos como ordenadores, teléfonos móviles y televisores, que han revolucionado nuestra forma de vida.
Aplicaciones prácticas del modelo del átomo en la tecnología actual
El modelo del átomo ha permitido el avance de la tecnología en una amplia gama de campos. Uno de los ejemplos más destacados es la tecnología de semiconductores. Gracias a la comprensión de los niveles de energía y las propiedades eléctricas de los átomos, se han desarrollado materiales semiconductores como el silicio, que son fundamentales en la fabricación de dispositivos electrónicos.
Otra aplicación práctica es la creación de fuentes de energía. El conocimiento del modelo del átomo ha llevado al desarrollo de tecnologías como la energía nuclear, donde se utiliza la fisión o fusión de los núcleos atómicos para generar electricidad de forma más eficiente. Además, la investigación en materiales con propiedades magnéticas, superconductores y luminescentes también está directamente relacionada con nuestra comprensión del modelo atómico.
Código ejemplo: Modelo del átomo
// Clase Átomo
class Atomo {
constructor(protones, neutrones, electrones) {
this.protones = protones;
this.neutrones = neutrones;
this.electrones = electrones;
}
calcularPesoAtomico() {
return this.protones + this.neutrones;
}
calcularCargaNuclear() {
return this.protones - this.electrones;
}
}
// Crear un átomo de hidrógeno
const hidrogeno = new Atomo(1, 0, 1);
console.log(hidrogeno.calcularPesoAtomico()); // Output: 1
console.log(hidrogeno.calcularCargaNuclear()); // Output: 0
En este código de ejemplo, hemos creado una clase "Átomo" con propiedades de protones, neutrones y electrones. También incluye métodos para calcular el peso atómico y la carga nuclear del átomo. Este ejemplo muestra cómo podemos utilizar los principios del modelo del átomo en programación y matemáticas, lo que demuestra una vez más su importancia en distintas áreas de la tecnología.
Cuáles son las teorías o hipótesis actuales que desafían el modelo del átomo conocido
El modelo del átomo ha sido objeto de múltiples teorías y eperimentos a lo largo de la historia. A medida que avanzan los descubrimientos científicos, es natural que se generen nuevas teorías o hipótesis que desafíen el modelo actualmente aceptado. En este sentido, eisten varias ideas y propuestas que buscan ampliar nuestra comprensión de la estructura interna del átomo.
1. El modelo de cuerdas
Una de las teorías más conocidas que desafía el modelo tradicional del átomo es la teoría de cuerdas. Según esta idea, las partículas fundamentales no serían puntos sin estructura, sino "cuerdas" unidimensionales vibrantes. Estas cuerdas vibrantes serían las responsables de generar todas las partículas subatómicas que conocemos. Esta teoría busca integrar la gravedad con las otras tres fuerzas fundamentales de la naturaleza: la fuerza electromagnética, la fuerza nuclear débil y la fuerza nuclear fuerte.
2. La teoría de las supercuerdas
También relacionada con el concepto de la teoría de cuerdas, encontramos la teoría de las supercuerdas, que propone que las partículas elementales son en realidad diferentes estados vibratorios de una sola entidad básica llamada "supercuerda". Esta teoría intenta resolver algunas cuestiones pendientes de la física de partículas, como la eistencia de la materia oscura y la gravedad cuántica. Además, la teoría de las supercuerdas sugiere la eistencia de más dimensiones del espacio-tiempo que no podemos percibir directamente.
3. El modelo holográfico
Otra teoría que desafía el modelo tradicional del átomo es el modelo holográfico. Según esta idea, toda la información sobre lo que ocurre en un volumen tridimensional podría ser codificada en una "superficie" bidimensional ubicada en sus fronteras. Esto implicaría que nuestra realidad tridimensional es solo una proyección o ilusión generada por esa información codificada en dicha superficie. Esta teoría ha sido aplicada eitosamente en la física teórica y ha demostrado su utilidad en la resolución de problemas relacionados con la gravedad cuántica y la materia oscura.
4. La teoría de los campos uni-tetradimensionales
Esta teoría propone una estructura completamente diferente para el átomo, basándose en conceptos de geometría no euclidiana y algebra matricial. Según esta hipótesis, cada partícula elemental estaría asociada a un campo "uni-tetradimensional" específico, y la interacción entre estos campos daría lugar a la diversidad de partículas subatómicas que conocemos. Esta teoría busca eplicar fenómenos que no pueden ser eplicados por el modelo estándar, como la masa y las cargas eléctrica y magnética de las partículas subatómicas.
A pesar de que estas teorías actuales desafían al modelo del átomo conocido, es importante destacar que aún están en desarrollo y no han sido completamente validadas eperimentalmente. Sin embargo, su eistencia nos muestra la continua evolución y búsqueda de respuestas dentro del ámbito de la física subatómica.
Preguntas frecuentes (FAQ)
1. ¿Cuál es el modelo actual del átomo?
El modelo actual del átomo es el modelo cuántico, que describe al átomo como un núcleo compuesto por protones y neutrones, rodeado de una nube de electrones distribuidos en niveles de energía.
2. ¿Qué importancia tiene el modelo del átomo en la ciencia moderna?
El modelo del átomo es fundamental en muchas áreas de la ciencia, como la química y la física cuántica, ya que nos permite entender cómo interactúan los elementos químicos y cómo se comportan las partículas subatómicas.
3. ¿Cómo ha evolucionado el modelo del átomo a lo largo del tiempo?
A lo largo del tiempo, el modelo del átomo ha ido evolucionando desde las ideas de los antiguos griegos, pasando por el modelo atómico de Dalton, el modelo de Thomson, el modelo de Rutherford y finalmente llegando al modelo cuántico actual.
4. ¿Qué aportó el modelo de Rutherford al estudio del átomo?
El modelo nuclear propuesto por Rutherford demostró que el átomo está compuesto en su mayoría por espacio vacío, con un núcleo central donde se concentra la mayor parte de la masa y carga positiva.
5. ¿Cuáles son las partículas subatómicas fundamentales según el modelo actual?
Las partículas subatómicas fundamentales según el modelo actual son los protones, neutrones y electrones. Los protones tienen carga positiva, los neutrones son neutros y los electrones tienen carga negativa.

Entradas relacionadas